Kutatási terület
A laboratórium munkatársai humán neurális organoid modelleket fejlesztenek, annak érdekében, hogy az idegrendszer betegségeinek korai, sejt típus specifikus patomechanizmusait tanulmányozhassuk. Ezek megismerésével olyan gyógyszer célpontokat lehet beazonosítani, amik az adott betegségek gyógyítását vagy akár megelőzését teszik lehetővé.
A labor fókuszában olyan neurodegeneratív betegségek állnak, mint az amiotrófiás laterálszklerózis és különböző típusú cerebelláris ataxiák. Az amiotrófiás laterálszklerózis egy jelenleg gyógyíthatatlan neurodegeneratív betegség, ami az előagy és a gerincvelő motorneuronjait és glia sejtjeit érinti, és a mozgásképesség teljes elvesztéséhez, majd 3-5 éven belül halálhoz vezet. A cerebelláris ataxiák különböző típusaiban szenvedő betegek mozgásukban erőteljesen korlátozottá válnak, amit a cerebellum sejtjeinek, a Purkinje neuronoknak a neurodegeneratív elváltozása okoz. A kutatóintézet Gyógyszerrezisztencia csoportjával és a Semmelweis Egyetem II. számú Gyermekklinikájával együttműködésben a szimpatikus idegrendszer rosszindulatú tumoros elváltozását, a neuroblasztómát is vizsgálják. A neuroblasztóma főleg 5 év alatti gyermekeket érint és a velősánc utódsejtjeinek elfajulása révén keletkezik. A magas kockázatú neuroblasztóma sok esetben halálos kimenetelű a kezelés során kialakuló terápiarezisztencia miatt.
A különböző neurodegeneratív és tumoros megbetegedések vizsgálatához a betegség által érintett terület modelljét szükséges használni, így az amiotrófiás laterálszklerózis esetében előagyi és gerincvelői organoid modelleket, a cerebelláris ataxiák különböző fajtáinak vizsgálatához cerebelláris organoid modellt hoztak létre, míg a neuroblasztóma során kialakuló terápia rezisztencia mechanizmusok feltérképezésére velősánc organoidok előállítását lehetővé tevő protokollt dolgoztak ki a labor munkatársai.
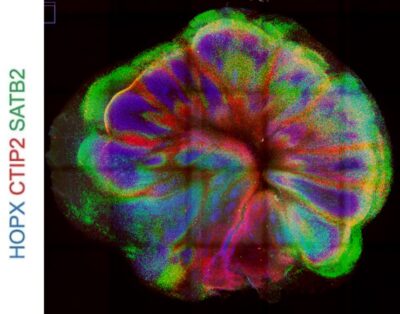
100 napos organoid szelet radiális gliával (HOPX), és a kortikális lemez II-IV rétegeire (SATB2) illetve a IV-VI rétegekre jellemző neuronokkal (CTIP2). A felvételt készítette: Lea Wenger. Forrás: Szebényi et al., Nat Neurosci 2021.
Az organoidokban keletkező sejtek érettebbek a kétdimenziós tenyésztési körülmények között létrehozott társaiknál, ezáltal a betegségekre jellemző elváltozások is erőteljesebben jelentkeznek bennük. Az organoidok gyógyszerfejlesztési folyamatokba történő bevonása emiatt rendkívül fontos feladat, de a nagy áteresztőképességű rendszerek használata háromdimenziós szövetek esetében egyelőre technikai nehézségekbe ütközik. Egy a vezető kutató által kidolgozott eljárás segítségével az organoid modellekből bizonyos sejttípusok kiválogathatók és kétdimenziós sejtenyészetekként tenyészthetők. Az organoid modellekből ilyen módon létrehozott tenyészeteket nagy áteresztőképességű gyógyszerfejlesztési platform kidolgozására használják.
Tagok
Szebényi Kornélia, vezető kutató (szebenyi.kornelia@ttk.hu)
Sándor Alexandra, PhD hallgató
Wasifa Nurieva, látogató PhD hallgató
Tusnády Simon, TDK hallgató
Elnyert támogatások
Szebényi Kornélia
- IBRO Return Home Fellowship 2022
- FK OTKA
- HORIZON-WIDERA-2022-TALENTS-02-01
Sándor Alexandra
- Új Nemzeti Kiválóság Program
- Kooperatív Doktori Program
Együttműködések
Humán Pluripotens Őssejt Laboratórium, Természettudományi Kutatóközpont, Budapest, Magyarország
Gyógyszerrezisztencia Kutatócsoport, Természettudományi Kutatóközpont, Budapest, Magyarország
- számú Gyermekklinika, Semmelweis Egyetem, Budapest, Magyarország
Lakatos Lab, Klinikai Idegtudományi Tanszék, Cambridge-i Egyetem, Cambridge, Egyesült Királyság
Ivics Lab, Orvosi Biotechnológia Részleg, Paul Ehrlich Intézet, Langen, Németország
Válogatott publikációk
Szebényi K, Füredi A, Bajtai E, Sama SN, Csiszar A, Gombos B, Szabó P, Grusch M, Szakács G. Effective targeting of breast cancer by the inhibition of P-glycoprotein mediated removal of toxic lipid peroxidation byproducts from drug tolerant persister cells. Drug Resist Updat. 2023 Nov;71:101007. doi: 10.1016/j.drup.2023.101007. Epub 2023 Sep 17. PMID: 37741091.
Szebényi K, Barrio-Hernandez I, Gibbons GM, Biasetti L, Troakes C, Beltrao P, Lakatos A. A human proteogenomic-cellular framework identifies KIF5A as a modulator of astrocyte process integrity with relevance to ALS. Commun Biol. 2023 Jun 29;6(1):678. doi: 10.1038/s42003-023-05041-4. PMID: 37386082; PMCID: PMC10310856.
Szebényi K, Wenger LMD, Sun Y, Dunn AWE, Limegrover CA, Gibbons GM, Conci E, Paulsen O, Mierau SB, Balmus G, Lakatos A. Human ALS/FTD brain organoid slice cultures display distinct early astrocyte and targetable neuronal pathology. Nat Neurosci. 2021 Nov;24(11):1542-1554. doi: 10.1038/s41593-021-00923-4. Epub 2021 Oct 21. PMID: 34675437; PMCID: PMC8553627.
Szabó Z, Héja L, Szalay G, Kékesi O, Füredi A, Szebényi K, Dobolyi Á, Orbán TI, Kolacsek O, Tompa T, Miskolczy Z, Biczók L, Rózsa B, Sarkadi B, Kardos J. Extensive astrocyte synchronization advances neuronal coupling in slow wave activity in vivo. Sci Rep. 2017 Jul 20;7(1):6018. doi: 10.1038/s41598-017-06073-7. PMID: 28729692; PMCID: PMC5519671.
Füredi A, Szebényi K, Tóth S, Cserepes M, Hámori L, Nagy V, Karai E, Vajdovich P, Imre T, Szabó P, Szüts D, Tóvári J, Szakács G. Pegylated liposomal formulation of doxorubicin overcomes drug resistance in a genetically engineered mouse model of breast cancer. J Control Release. 2017 Sep 10;261:287-296. doi: 10.1016/j.jconrel.2017.07.010. Epub 2017 Jul 9. PMID: 28700899.
Szebényi K, Füredi A, Kolacsek O, Pergel E, Bősze Z, Bender B, Vajdovich P, Tóvári J, Homolya L, Szakács G, Héja L, Enyedi Á, Sarkadi B, Apáti Á, Orbán TI. Generation of a Homozygous Transgenic Rat Strain Stably Expressing a Calcium Sensor Protein for Direct Examination of Calcium Signaling. Sci Rep. 2015 Aug 3;5:12645. doi: 10.1038/srep12645. PMID: 26234466; PMCID: PMC4522653.
Szebényi K, Füredi A, Kolacsek O, Csohány R, Prókai Á, Kis-Petik K, Szabó A, Bősze Z, Bender B, Tóvári J, Enyedi Á, Orbán TI, Apáti Á, Sarkadi B. Visualization of Calcium Dynamics in Kidney Proximal Tubules. J Am Soc Nephrol. 2015 Nov;26(11):2731-40. doi: 10.1681/ASN.2014070705. Epub 2015 Mar 18. PMID: 25788535; PMCID: PMC4625667.
Szebényi K, Péntek A, Erdei Z, Várady G, Orbán TI, Sarkadi B, Apáti Á. Efficient generation of human embryonic stem cell-derived cardiac progenitors based on tissue-specific enhanced green fluorescence protein expression. Tissue Eng Part C Methods. 2015 Jan;21(1):35-45. doi: 10.1089/ten.TEC.2013.0646. PMID: 24734786; PMCID: PMC4291086.
Fotók



