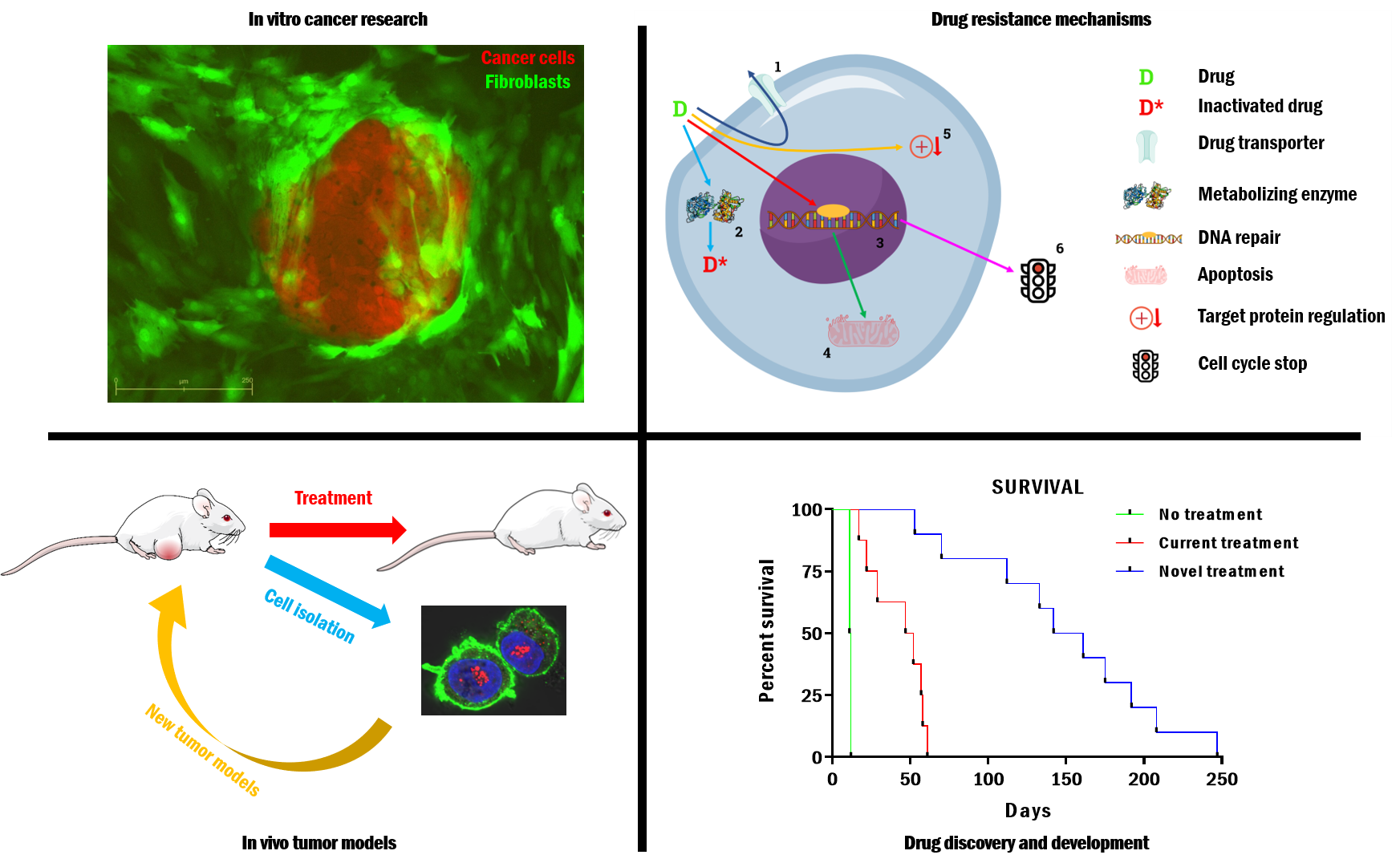
Általános kutatási terület
A korszerű daganatellenes terápia jelentős sikerei ellenére a kemoterápiával szemben fellépő rezisztencia (multidrog rezisztencia, MDR) továbbra is megoldásra váró klinikai kihívás. Számos rosszindulatú, valamint áttétet adó daganatos megbetegedés hatékony kezelése a terápia során rendszerint kialakuló MDR hatás miatt a mai napig nem megoldott. A rezisztens fenotípus gyakran társul az ABC-transzporterek családjába tartozó fehérjék emelkedett expressziójával. E család legismertebb képviselője az MDR1/Pgp (P-glikoprotein) membránfehérje, mely az ATP energiáját felhasználva megakadályozza a citosztatikus vegyületek sejten belüli felhalmozódását. A transzporter gátlásával az in vitro tenyésztett sejtek rezisztenciája áttörhető, ám a klinikai próbák tanúsága szerint ez a stratégia nem alkalmas a drog-rezisztens tumorok eliminálására. Kutatásunk radikálisan új megoldást vet fel: megfigyeltük, hogy a Pgp funkciója paradox módon fokozza az egyébként multidrog rezisztens sejtek érzékenységét. Megközelítésünk szerint ezért a P-glikoprotein, mely a klinikai drogrezisztencia univerzális markere, egyben a multidrog rezisztens tumorsejtek molekuláris targetje („Achilles-ina”) lehet.
Az Organikus anion transzporter polipeptidek (Organic anion transporting polypeptides, OATP) a sejtmembránban megtalálható SLC (Solute Carrier) típusú membránfehérjék, amelyek szerves anyagok (jellemzően nagyméretű amfipatikus vagy anionos molekulák) sejtbeli felvételét segítik elő. Az OATP-k működése az emberi szervezet epesó- és hormonháztartásának fenntartásában fontos. Mivel azonban az OATP fehérjecsalád több tagja gyógyszerhatóanyagokat is felismer, működésük befolyásolja gyógyszerszubsztrátjaik szervezeten belüli eloszlását és hatékonyságát. A farmakokinetikában meghatározó szerepük miatt, egy új gyógyszerhatóanyag fejlesztése során a májban kifejeződő OATP1B1 és OATP1B3 fehérjékkel való kölcsönhatás vizsgálatát nemzetközi szabályozó hatóságok (FDA, EMA, PMDA) írják elő. Az OATP fehérjék megváltozott, jellemzően fokozott expressziót mutatnak különféle tumorokban, azonban ennek jelentősége a tumor progressziójában és a kezelésre adott válaszban nem tisztázott. A tumorokban fokozottan megjelenő OATP-ken kívül az OATP család kevésbé jellemzett tagjai, például a központi idegrendszer hormon transzporter OATP-i is potenciális farmakológiai célpontok.
Főbb kutatási témák
MDR-szelektív vegyületek felfedező kutatása
2010-12 között a csoport megkezdte az ún. MDR-szelektív vegyületek felfedező kutatását és fejlesztését. Elsőként sikerült olyan molekulákat azonosítanunk, melyek hatékonyan elpusztítják az egyébként rezisztens tumorsejteket. Kidolgoztunk egy, az MDR-szelektív vegyületek in vitro szűrésére alkalmas fluoreszcens esszét, melyhez sejtvonalakat hoztunk létre. A fluoreszcens MDR-szelektivitási esszé segítségével további MDR-szelektív vegyületeket azonosítottunk, ezekre farmakofór modellt illesztettünk. A TTK SZKI kutatócsoportjával közösen (Dr. Soós Tibor) célzott kémiai fejlesztést végeztünk. Felállítottuk a multidrog rezisztens tumorok vizsgálatára alkalmas in vivo esszéket.
Az ABCB6 fehérje biokémiai és sejtbiológiai jellemzése
Az általánosan elfogadott nézet szerint az ABCB6 fehérje a mitokondrium külső membránjában fejeződik ki. E feltételezést a mitokondriális fehérjékkel lévő nagyfokú szekvencia-hasonlóságon túl számos publikáció támasztotta alá, melyek döntően az ABCB6 fehérjét overexpresszáló sejteken végzett sejtfrakcionálási, illetve konfokális mikroszkópiás kísérletek eredményein alapultak. A fehérje sejten belüli elhelyezkedésével összhangban az ABCB6 transzporter feltételezett élettani szerepe a porfirin metabolitok mitokondriális importja, ezáltal az eritroid érés szabályozása volt. Kutatásaink eredménye szerint az ABCB6 valójában az endolizoszómális rendszer része, a mitokondriumban nem található meg. Kimutattuk, hogy az ABCB6 kifejeződik a vörösvérsejtekben és a retikulocitákban, valamint a retikulocitákban keletkező exoszómákban.
Az antimaláriás gyógyszerek és a növényvédő vegyszerekkel szemben kialakuló rezisztencia molekuláris alapjai
Kísérleteink az antimaláriás gyógyszerekkel szemben kialakuló rezisztenciát biztosító egyik gyakori mechanizmus, a pfmdr1 ABC transzporter jellemzésére irányultak. A nemzetközi kollaborációban folytatott kutatás célja új maláriaellenes gyógyszerek fejlesztése és a malária kezelésének optimalizálását segítő in vitro tesztek kifejlesztése.
Fluoreszcens eljárások fejlesztése gyógyszerkölcsönhatások vizsgálatára
A közelmúltban olyan fluoreszcens eljárásokat fejlesztettünk, amelyek segítségével a farmakológiailag jelentős vagy egyelőre kevéssé jellemzett OATP-k vizsgálhatók1-6. Ezt a kutatási irányt folytatva olyan fluoreszcens módszer kifejlesztésén dolgozunk, amely alkalmas az OATP-k szubsztrátjainak és nem transzportálódó inhibitorainak egyszerű elkülönítésére.
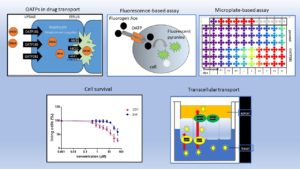
Egy tumorspecifikus OATP jellemzése
Kutatócsoportunk vizsgálja az egészséges májban kifejeződő OATP1B3 fehérje tumorokban kifejeződő változatát. Célunk annak kiderítése, hogyan befolyásolja ez a fehérjeváltozat a tumorsejtek gyógyszerérzékenységét és proliferációját.
OATP-k endogén és exogén molekulákkal való kölcsönhatásának vizsgálata
Együttműködés keretében több potenciális, mesterséges vagy természetes eredetű OATP inhibitort vizsgáltunk7-9. Az általunk létrehozott modell sejtvonalak és fluoreszcens módszerek segítségével a multispecifikus OATP-k és szteroidok, illetve az emberi szervezetbe bekerülő toxinok közötti kölcsönhatást vizsgáljuk annak érdekében, hogy specifikus, nagy affinitású inhibitorokat vagy esetleges OATP-mediálta toxicitást azonosítsunk.
Fontosabb publikációk:
- Patik I, Kovacsics D, Német O, Gera M, Várady G, Stieger B, Hagenbuch B, Szakács G, Özvegy-Laczka C. Functional expression of the 11 human Organic Anion Transporting Polypeptides in insect cells reveals that sodium fluorescein is a general OATP substrate. Biochem Pharmacol. 2015 Dec 15;98(4):649-58.
- Patik I, Székely V, Német O, Szepesi Á, Kucsma N, Várady G, Szakács G, Bakos É, Özvegy-Laczka C. Identification of novel cell-impermeant fluorescent substrates for testing the function and drug interaction of Organic Anion-Transporting Polypeptides, OATP1B1/1B3 and 2B1. Sci Rep. 2018 8:2630
- Bakos E, Tusnády GE, Német O, Patik I, Magyar Cs, Németh K, Kele P, Özvegy-Laczka C. Synergistic transport of a fluorescent coumarin probe marks coumarins as pharmacological modulators of Organic anion-transporting polypeptide, OATP3A1. Biochemical Pharmacology, 2020 Dec;182:114250.
- Bakos É, Német O, Patik I, Kucsma N, Várady G, Szakács G, Özvegy-Laczka C. A novel fluorescence-based functional assay for human OATP1A2 and OATP1C1 identifies interaction between third-generation P-gp inhibitors and OATP1A2. FEBS J. 2020 Jun;287(12):2468-2485.
- Székely V, Patik I, Ungvári O, Telbisz Á, Szakács G, Bakos É, Özvegy-Laczka C. Fluorescent probes for the dual investigation of MRP2 and OATP1B1 function and drug interactions. Eur J Pharm Sci. 2020 Aug 1;151:105395.
- Ungvári O, Király L, Bakos É, Özvegy-Laczka C. 8-acetoxy-trisulfopyrene as the first activatable fluorogenic probe for add-and-read assessment of Organic anion-transporting polypeptides, OATP1B1, OATP1B3, and OATP2B1. FASEB J. 2021 Sep;35(9):e21863.
- Laczkó-Rigó R, Bakos É, Jójárt R, Tömböly C, Mernyák E, Özvegy-Laczka C. Selective antiproliferative effect of C-2 halogenated 13α-estrones on cells expressing Organic anion-transporting polypeptide 2B1 (OATP2B1). Toxicol Appl Pharmacol. 2021 Aug 30;429
- Jójárt R, Laczkó-Rigó R, Klement M, Kőhl G, Kecskeméti G, Özvegy-Laczka C, Mernyák E. Design, synthesis and biological evaluation of novel estrone phosphonates as high affinity organic anion-transporting polypeptide 2B1 (OATP2B1) inhibitors. Bioorg Chem. 2021 Jul;112:104914
- Mohos V, Fliszár-Nyúl E, Ungvári O, Bakos É, Kuffa K, Bencsik T, Zsidó BZ, Hetényi C, Telbisz Á, Özvegy-Laczka C, Poór M. Effects of chrysin and its major conjugated metabolites chrysin-7-sulfate and chrysin-7-glucuronide on cytochrome P450 enzymes, and on OATP, P-gp, BCRP and MRP2 transporters. Drug Metab Dispos. 2020 Oct;48(10):1064-1073
Aktuális együttműködések
Szerves Kémiai intézet, TTK
Szegedi Tudományegyetem
Pécsi Tudományegyetem
Zürichi Egyetem
Bécsi Egyetem
Vezető
Szakács Gergely