Általános kutatási terület
Kutatásaink középpontjában a nem-kódoló genom rák kialakulásában betöltött szerepének funkcionális vizsgálata áll, elsősorban vastagbélrák modelleket alkalmazva. A nem-kódoló genetikai variánsok (egy nukleotid variáns (SNP)), mint betegségre hajlamosító tényezők, funkcionális jelentőségét kívánjuk feltárni különböző epigenetikai módszerek, genomszerkesztési technikák és számítógépes megközelítések segítségével. Emellett szeretnénk azonosítani és jellemezni azokat a funkcionális szabályozó elemeket is, amelyek hozzájárulnak a daganatos betegség kialakulásához. A fenti erőfeszítések eredményeit felhasználva végső célunk a betegség minél korábbi felismerésén túl, új terápiás célpontok azonosítása.
Főbb kutatási témák
- Betegségre hajlamosító genetikai variánsok vizsgálata
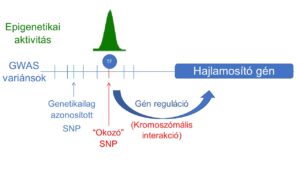
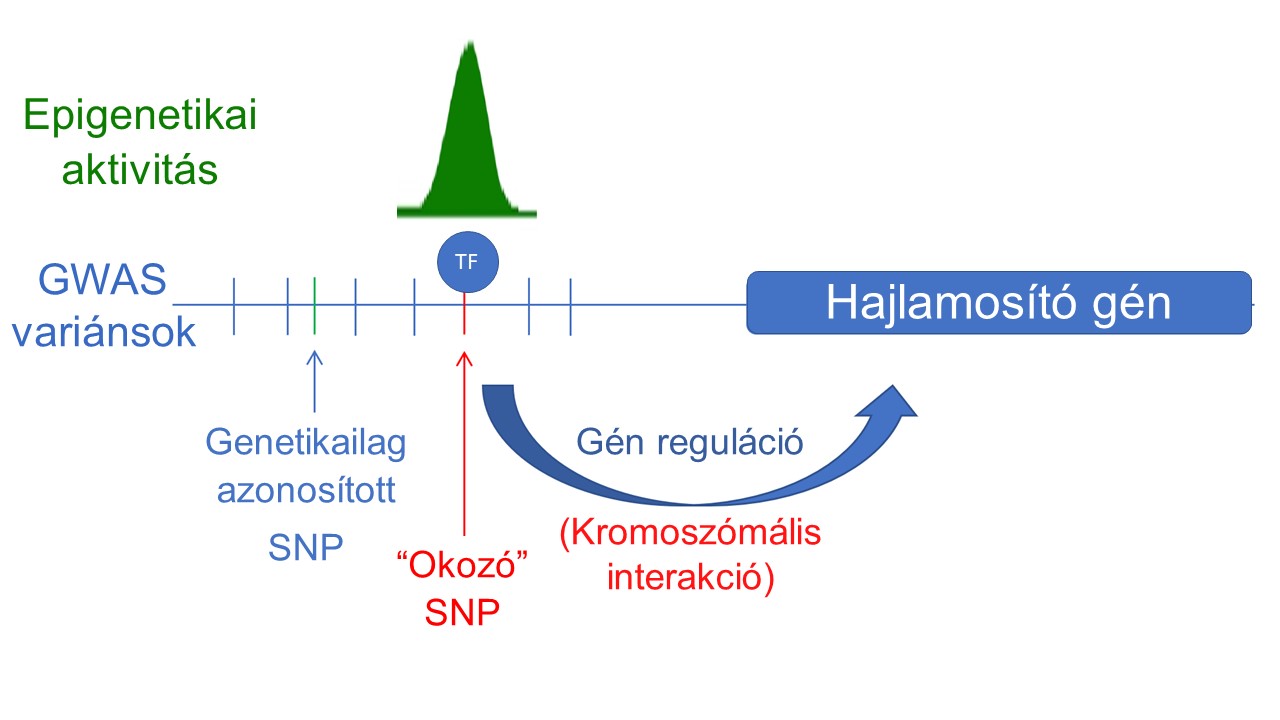
Célunk az elsősorban genom-szintű asszociációs vizsgálatok (GWAS) révén azonosított öröklődő, nem kódoló (csírasejtes) mutációk szerepének, hatásának és funkciójának feltárása a rák kialakulásában. Ennek tanulmányozása azonban számos olyan ok miatt nagy kihívást jelent, mint például a genetikai korreláció (kapcsolati egyensúlytalanság (LD)), a cisz-szabályozás (nincs genetikai kód), a gyenge fenotípusok, az összetett (nem SNP) genetikai variánsok jelenléte, a rendelkezésre álló modellrendszerek hiányosságai és egyéb módszertani korlátok. Az akadályok leküzdése érdekében ezért elsődleges célunk a rák kialakulásával összefüggő ok-okozati variánsok (causal variant) azonosítása és átfogó vizsgálata, melyhez precíz genom- és epigenomszerkesztési technikákat, egysejtes klónozást és sejtalapú vizsgálatokat alkalmazunk (Spisak és mtsai, Nat. Med, 2015 link) (magyar összefoglaló link). Továbbá törekszünk arra, hogy érzékenyebb rendszereket és assay-ket fejlesszünk ki, amelyek olyan kifinomult fenotípusokat használnak fel, mint a génexpresszió, a sejtek állapota és morfológiája, lehetővé téve végső soron a reakciók párhuzamosítását és a felskálázhatóságot.
- Az enhanszerek (erősítő elemek) biológiája
A cisz-szabályozó elemek közé tartozó enhanszerek a nem kódoló DNS specifikus szegmensei, amelyek távoli gének átíródását irányítják. Kölcsönhatásba lépve a transzhatású transzkripciós faktorokkal (TF) fokozzák a célgének kifejeződését. Számos nagyfelbontású genom-szintű szekvenáláson alapuló tanulmány bizonyította, hogy az enhanszerek gyakran íródnak át hosszú, nem kódoló RNS-ekké (lncRNS) vagy enhancer RNS-ekké (eRNS). Ezeknek a molekuláknak a szintje gyakran korrelál a célgén mRNS kifejeződésének mértékével. Kutatásaink célja a rák-specifikus enhanszerek azonosítása és hatásmechanizmusuk vizsgálata, beleértve a TF-hoz való kötődést, aktiválást, kölcsönhatást és szövetspecifikus működést. Továbbá törekszünk a rák kialakulásával összefüggő megváltozott célgén-expresszió biológiai következményeinek megértésére is (Takeda és Spisak et al, Cell, 2018 link) (magyar összefoglaló link).
- A daganat korai felismerés és nem-invazív kimutatása
Az epigenetikai változások, különösen a DNS-metiláció és a hiszton-módosulások, gyakran mutatnak szövet- és rák-specifikus mintázatokat. Az epigenetikai mintázatok átrendeződésének vizsgálata a rák kialakulása során, folyadék biopsziás technológiával integrálva, nagy lehetőségeket rejt magában az epigenetikai változások jobb megértése és a korai rákfelismerési stratégiák fejlesztése szempontjából, melyek szintén kutatási céljaink között szerepelnek (Nuzzo, Berchuck, Korthauer and Spisak et al, Nat.Med. 2020 link).
Legújabb publikációink
Vízkeleti L., Spisák S., Rewired Metabolism Caused by the Oncogenic Deregulation of MYC as an Attractive Therapeutic Target in Cancers, Cells 2023, 12(13), 1745; link
Prosz A., Pipek O., Börcsök J., Palla G., Szallasi Z., Spisak S.*, Csabai I. Biologically informed deep learning for explainable epigenetic clocks.
Spisak S., Tisza V., Nuzzo PV., Seo JH., Pataki B., Ribli D., Sztupinszki Z., Bell C., Rohanizadegan M., Stillman DR., Alaiwi SA., Bartels AB., Papp M., Shetty A., Abbasi F., Lin X., Lawrenson K., Gayther AS., Pomerantz M., Baca S., Solymosi N., Csabai I., Szallasi Z., Gusev A., Freedman ML., A biallelic multiple nucleotide length polymorphism explains functional causality at the 5p15.33 prostate cancer risk locus.
Pre-print
Vizkeleti L., Kiss C., Tisza V., Szigeti A., Gellert A., Csabai I., Pongor LS., Spisak S.,# (2023) Epigenetic regulation explains the functionality behind colon cancer specific biomarker Septin9. BioRxiv
Prosz A., Duan H., Tisza V., Sahgal P., Topka S., Klus GT., Börcsök J., Sztupinszki Z., Hanlon T., Diossy M., Vizkeleti L., Stormoen DR., Csabai I., Pappot H., Vijay J., Offit K., Ried T., Sethi NS., Mouw KW, Spisak S#, Pathania S#, Szallasi Z# (2023) Nucleotide excision repair deficiency is a targetable therapeutic vulnerability in clear cell renal cell carcinoma. BioRxiv
Gusev A.*, Spisak S.*, Fay AP., Carol H., Vavra KC., Signoretti S., Tisza V., Pomerantz M., Abbasi F., Seo JH., Choueiri TK., Lawrenson K., Freedman ML., Allelic imbalance reveals widespread germline-somatic regulatory differences and prioritizes risk loci in Renal Cell Carcinoma. BioRxiv
Spisak S., Chen D., Likasitwatanakul P., Doan P., Li X., Vizkeleti L., Tisza V., Silva PD., Giannakis M., Wolpin B., Qi J., Sethi NS., Utilizing a dual endogenous reporter system to identify functional regulators of aberrant stem cell and differentiation activity in colorectal cancer. BioRxiv
Csoportkép (2023)

Vezető
Dr. Spisák Sándor (publikációk)