A Biological Soft Matter Platform honlapja
A Biomolekuláris Önrendeződés “Lendület” Kutatócsoport honlapja
Kutatási területek:
Membránaktív önrendeződő peptidek
Kutatócsoportunkban membrán-aktivitással rendelkező vegyületek, főként membránaktív peptidek vizsgálatát végezzük, a fő hangsúlyt a szerkezet és működés közötti összefüggések feltárására helyezve.
A természetben előforduló membránaktív peptidek, más néven gazdavédő peptidek, a veleszületett immunrendszer részeként segítik a patogén mikroorganizmusok elleni harcot. Nemcsak a baktériumok és gombák elpusztítására képesek, hanem vírusellenes és rákellenes aktivással is rendelkeznek. Hatásukat főként a célsejt membránjának károsítása révén fejtik ki, de emellett immunszabályozó szerepük is lehet. A hagyományos terápiás antibiotikumoknak ellenálló baktériumok elterjedése napjaink egyik legfenyegetőbb egészségügyi problémája, amelynek egyik lehetséges megoldása lehet új típusú, peptid-alapú antibakteriális hatású szerek fejlesztése és alkalmazása. A humánegészségügyi vonatkozásokon túl az antimikrobiális peptideket számos más területen is lehet hasznosítani; potenciálisan felhasználhatók a mezőgazdaságban növényvédőszerként, az állattenyésztésben takarmányadalékanyagként, az élelmiszeriparban tartósítószerként, de akár szennyvízkezelés során is a nemkívánatos baktériumtenyészetek kialakulásának elkerülésére vagy a meglévők megszüntetésére.
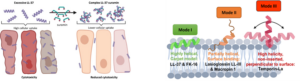
Bár a természetes membránaktív peptidek számos előnyös tulajdonsággal rendelkeznek a hagyományos antibiotikumokkal összevetve, a gyógyászatban való hasznosíthatóságuknak gátat szabhat az, hogy proteolitikus enzimek hatására gyorsan elbomlanak. Ennek kivédésére előállíthatunk a természetes szekvenciákon alapuló, azok szerkezetét és tulajdonságait utánzó olyan peptidmimetikus vegyületeket, melyek ellenállnak a proteolitikus hasításnak. A természetben nem előforduló elemekből felépülő peptidek kiváló önszerveződő képességekkel rendelkezhetnek, ami tervezéssel hangolható, így változatos szupramolekuláris szerkezetek hozhatók létre. Ennek megfelelően a nem-természetes peptidek alkalmazhatósági területe is rendkívül széles, a rákellenes vagy antibakteriális készítményektől kezdve a mesterséges polimercsövekig.
Válogatott közlemények a témához kapcsolódóan:
- Juhász et al “Interplay Between Membrane Active Host Defense Peptides And Heme Modulates Their Assemblies And In Vitro Activity” (2021) SciRep
- Quemé-Peña et al “Membrane Association Modes Of Natural Anticancer Peptides: Mechanistic Details On Helicity, Orientation, And Surface Coverage” (2021) IJMS
- Zsila et al “Quorum Sensing Pseudomonas Quinolone Signal Forms Chiral Supramolecular Assemblies With The Host Defense Peptide Ll-37” (2021) Front Mol Biosci
- Ricci et al “Anionic Food Color Tartrazine Enhances Antibacterial Efficacy Of Histatin-Derived Peptide Dhvar4 By Fine-Tuning Its Membrane Activity” (2020) QRB
- Szigyártó et al“Membrane Active Janus-Oligomers Of β ³-Peptides” (2020) Chem Sci
- Udyavara Nagaraj et al “Stimuli-Responsive Membrane Anchor Peptide Nanofoils for Tunable Membrane Association and Lipid Bilayer Fusion” (2022) ACS Appl Mater Interfaces
Extracelluláris vezikulák tervezése
A kutatócsoport az extracelluláris vezikulák standardizált izolációs és jellemzési protokolljainak kidolgozására és ezen vezikulák fehérje koronájának eltávolítására és elválasztására összpontosít.
Az extracelluláris vezikulák (EVk) foszfolipid kettősréteggel körülvett biológiai nanorészecskék, amelyeket a különböző sejtek bocsájtanak ki az extracelluláris térbe. Sejtes eredetük, biogenezisük és fizikai-kémiai tulajdonságaik alapján csoportosíthatók. Különböző típusú biomolekulákat (például DNS-t, RNS-t, fehérjéket, foszfolipideket) hordozhatnak, amelyek az őket termelő sejtekre jellemzők. A membránfehérjék mellett, az in vivo rendszerek a felületükön adszorbeált biomolekulákat is tartalmazhatnak, amely fehérje koronaként ismert. Az EVk az intracelluláris kommunikáció fontos résztvevői, továbbá számos fiziológiai és kóros folyamatban vesznek részt, így információval szolgálhatnak a különböző betegségek korai diagnosztizálásához és kezeléséhez. Ezen szerepeken túl, felhasználhatók különböző gyógyszerek, élelmiszer-tápanyagok, szervetlen nanorészecskék stb. potenciális szállító rendszereként. Ezért fontos a fehérje korona összetétele, modulálása és jellemzése, ami befolyásolhatja biohasznosulákat, biodisztibúciójukat és alkalmazhatóságukat.

Válogatott közlemények a témához kapcsolódóan:
- Szigyártó et al., Flow-Alignment of Extracellular Vesicles: Structure and Orientation of Membrane Associated Biomacromolecules Studied with Polarized Light, 2018, ChemBioChem
- Singh et al., Membrane Active Peptides Remove Surface Adsorbed Protein Corona from Extracellular Vesicles of Red Blood Cells, 2020, Frontiers in Chemistry
Számításos membrán biológia
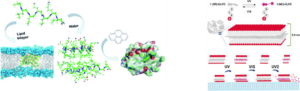
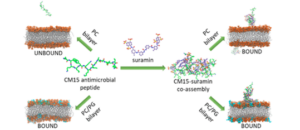
Az eddig bemutatott kísérleti módszerek mellett foglalkozunk teljes atomos Molekuladinamika (MD), durvarészecskés MD illetve kvantumkémiai szimulációkkal. A szimulációkban számos antimikrobiális peptidet (AMP) vizsgálunk, hogy megismerjük jobban a viselkedésüket és kötődésüket komplex membránokhoz, extracelluláris vezikulákhoz (EV). Különösen érdekli csoportunkat kismolekulák (pl. kismolekulás gyógyszerek, színezékek, bakteriális és humán jelző vegyületek stb.) kölcsönhatásai peptidekkel. Nagy hangsúlyt fektetünk arra, hogy megértsük ezen kölcsönhatások milyen szerkezeti változásokat okoznak a peptidekben, illetve hogyan befolyásolják a peptidek kötődését a membránokhoz. A tanulmányainkat gyakran kiegészítjük Dokkolással. A Dokkolás segít azonosítani a kezdeti kötődési helyét molekuláknak nagyobb rendszereken, így segítve modelt alkotni, amikor kísérletekből nem áll rendelkezésre elég információ a szerkezetekről. Továbbá a szimulációk révén tudunk számítani elektrosztatikus potenciált, entrópiát illetve szabadentalpia változást, valamint egyéb paramétereket is lehet számítani, melyek segítik az összehasonlítását különböző rendszereknek. Végül csoportunk használ kvantumkémiai számításokat is rendszeresen, például, hogy parametrizálva legyen egy molekula MD szimulációhoz, valamint, hogy fotofizikai és konformációs tulajdonságokkal jellemezzünk molekulákat.
Válogatott közlemények a témához kapcsolódóan:
- Kohut, Gergely, Tünde Juhász, Mayra Quemé-Peña, Szilvia Bosze, and Tamás Beke-Somfai. 2021. “Controlling Peptide Function By Directed Assembly Formation: Mechanistic Insights Using Multiscale Modeling On An Antimicrobial Peptide–Drug–Membrane System”. Acs Omega 6 (24). American Chemical Society (ACS): 15756-15769.
- Quemé-Peña, Mayra, Tünde Juhász, Gergely Kohut, Maria Ricci, Priyanka Singh, Imola Cs. Szigyártó, Zita I. Papp, Lívia Fülöp, and Tamás Beke-Somfai.(01/2021AD) 2021. “Membrane Association Modes Of Natural Anticancer Peptides: Mechanistic Details On Helicity, Orientation, And Surface Coverage”. International Journal Of Molecular Sciences 22 (16).
- Szigyártó, Imola Cs., Judith Mihály, András Wacha, Dóra Bogdán, Tünde Juhász, Gergely Kohut, Gitta Schlosser, et al. 2020. “Membrane Active Janus-Oligomers Of Β ³ -Peptides”. Chemical Science 11: 6868–6881
- Pothoff, Jan, Krzysztof Kamil Bojarski, Gergely Kohut, Agnieszka G Lipska, Adam Liwo, Efrat Kessler, Sylvie Ricard-Blum, and Sergey A. Samsonov. 2019. “Analysis Of Procollagen C-Proteinase Enhancer-1/Glycosaminoglycan Binding Sites And Of The Potential Role Of Calcium Ions In The Interaction”. International Journal Of Molecular Sciences 20 (20).
- Zsila, Ferenc, Gergely Kohut, and Tamás Beke-Somfai. (05/2019AD) 2019. “Disorder-To-Helix Conformational Conversion Of The Human Immunomodulatory Peptide Ll-37 Induced By Antiinflammatory Drugs, Food Dyes And Some Metabolites”. International Journal Of Biological Macromolecules 129: 50-60.
- Kohut, Gergely, Adam Sieradzan, Ferenc Zsila, Tünde Juhász, Szilvia Bosze, Adam Liwo, Sergey A. Samsonov, and Tamás Beke-Somfai. 2019. “The Molecular Mechanism Of Structural Changes In The Antimicrobial Peptide Cm15 Upon Complex Formation With Drug Molecule Suramin: A Computational Analysis”. Physical Chemistry Chemical Physics 21: 10644–10659.
- Kohut, Gergely, Adam Liwo, Szilvia Bosze, Tamás Beke-Somfai, and Sergey A. Samsonov. 2018. “Protein-Ligand Interaction Energy-Based Entropy Calculations: Fundamental Challenges For Flexible Systems”. The Journal Of Physical Chemistry B.
Vezető
Beke-Somfai Tamás

