Bemutatkozás, fő kutatási terület:
A Biomolekuláris Kölcsönhatások Kutatócsoport a fehérje-fehérje és fehérje-kismolekula kölcsönhatásokat vizsgálja biofizikai/biokémia módszerekkel és rendszerbiológiai szemlélettel. A vizsgálatok a molekuláris szinttől a sejtes viselkedés szintjéig terjednek. A csoport fő kutatási területe a sejtes jelátvitel során létrejövő komplexek szerkezetének meghatározása és a komponensek közötti kölcsönhatások analízise. Munkánk során in vitro módszereket, például három-dimenziós szerkezetmegoldás, fehérje-fehérje kölcsönhatás és enzimaktivitás mérésére alkalmas technikákat, sejtes alapú esszéket, jelátviteli hálózatok működésére vonatkozó számítógépes szimulációkat és nagyléptékű kísérletes módszereket használunk. A rendszerbiológiai megközelítés célja olyan target fehérjék és jelátviteli komplexek azonosítása, melyek „támadása” révén a sejtnövekedés és sejthalált szabályozó folyamatokat befolyásolni tudjuk. Célunk, hogy a rákos és gyulladásos betegségek kialakulására jellemző fehérjekináz aktivitás-mintázatokat új molekulák tervezése/szintézise révén gátoljuk. A csoport tevékenységéhez tartozik új molekulatárak létrehozása, kísérletes szűrése, illetve az itt azonosított vezérvegyületek szerkezet-funkció vizsgálata és szerkezet alapú, racionális fejlesztése.
Fehérje kinázok szerepe a sejtes jelátvitelben
Számos betegség (pl. rák, gyulladás) kialakulása a sejtes jelátviteli folyamatok zavaraira vezethető vissza. Sejtjeinket milliónyi környezeti inger éri, amire a megfelelő biológiai választ kell adniuk. Ennek a sok ingernek az érzékelését, sejten belüli „összegzését”, majd a megfelelő végrehajtó fehérje aktiválását egy komplex fehérje hálózat végzi. A végrehajtó fehérjék lehetnek metabolikus enzimek, transzkripciós faktorok vagy sejtmozgást befolyásoló sejtváz komponensek, melyek fehérjefoszforiláció révén szabályozhatóak. A fehérjefoszforilációt végző fehérjekinázok ugyanakkor jelátviteli kaszkádokat alkotnak és egymáshoz is kötnek. A sejtek növekedését és pusztulását szabályzó jelpályák a különböző kináz komplexeken keresztül „futnak össze”.
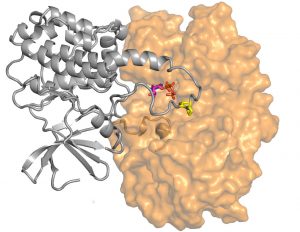
A sejtnövekedés egyik irányító központjának szerkezete. Az ábra az ERK2-RSK1 fehérje kinázok (narancs és szürke) kölcsönhatásának molekuláris felvételét mutatja. A sárga színnel jelzett fehérjeszakasz egy molekuláris kapcsoló elvén működik, a narancssárga fehérje ezt a részt módosítja, ezáltal a szürkét aktív állapotba löki, s ez végül sejtosztódást indít be. Fenti három-dimenziós, atomi felbontású térkép segítségével olyan hatóanyagot tervezhetünk, ami a kapcsolót folyamatosan „kikapcsolt” állapotban tartja, s így rákos folyamatok ellenében képes hatni.
A fehérjekinázok működését kórokozók is gyakran befolyásolják. A Kaposi-szarkóma ORF45 fehérjéje kötődik az aktív ERK-RSK kináz komplexhez és ezáltal fokozza a sejtnövekedést serkentő jelpálya aktivitását. A komplexen belüli kölcsönhatások logikájának az ismeretében és biokémiai szempontból helyes modell alapján futtatott számítógépes szimulációk segítségével megérthetjük, hogy a vírusfehérje hogyan „téríti el” az ERK-RSK komplex működését. ORF45 az RSK és az ERK sejtnövekedést szabályzó enzimek felszíneit rövid lineáris motívumokkal „támadja”, amik utánozzák az enzimek természetes kölcsönhatópartnereit. Érdekes, hogy ezeket a felszíneket a pestis baktérium és az enkefalomielitisz vírus fehérjéi is támadják.
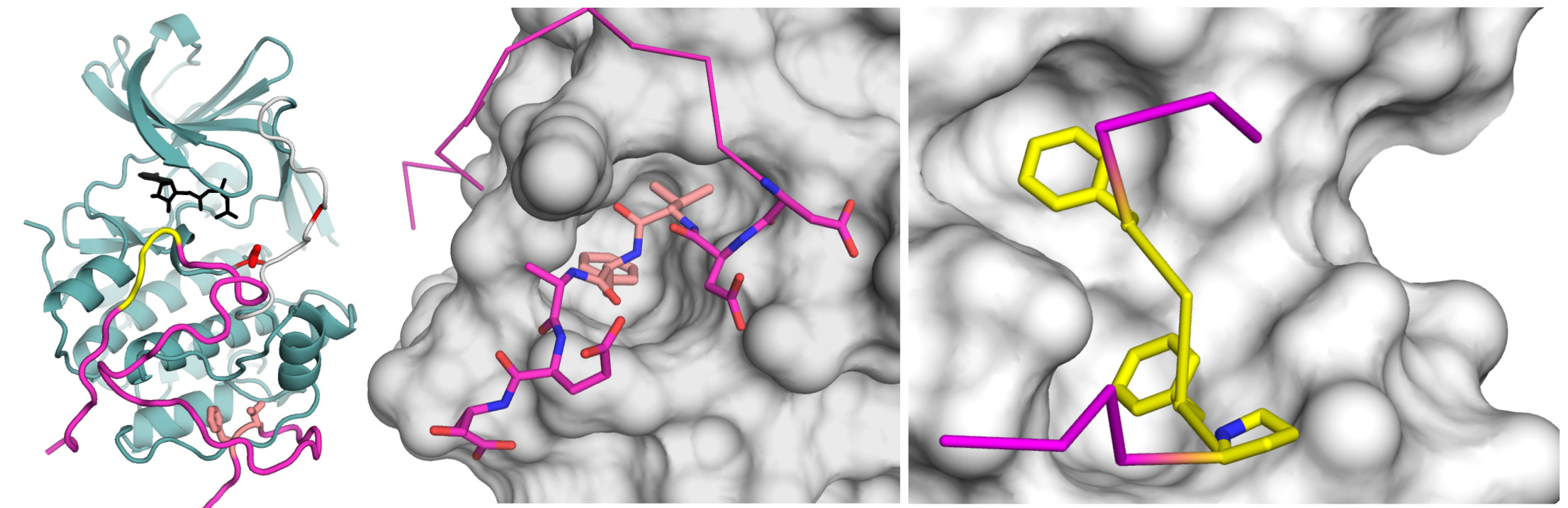
Egy vírusfehérje trükkjei az ERK-RSK komplexen. A Kaposi-szarkóma ORF45 fehérje (bíbor) és az RSK2 nevű kináz (kékeszöld) komplexének térbeli szerkezete, illetve az RSK2 és az ERK2 nevű sejtnövekedést szabályzó enzimek (kinázok) felszíneinek „támadása” a vírus fehérje rövid szakaszai (lazac illetve sárga) révén.
Jelátviteli kölcsönhatások gátlására alkalmas vegyületek fejlesztése
A jelenlegi hatóanyag-tervezési stratégiák a jelátvitelt fehérjekinázok aktivitásának közvetlen gátlásán keresztül próbálják meg befolyásolni. A kinázok fehérje-fehérje kölcsönhatásainak gátlására épülő stratégiák viszont sokkal specifikusabb inhibitorok előállítását tennék lehetővé. Célunk olyan vegyületek előállítása, melyek a klasszikus, enzimaktivitást gátló vegyületeknél lényegesen specifikusabb módon képesek jelátviteli átmeneteket befolyásolni, például kinázok interakciós partnereikkel való kölcsönhatásainak gátlása révén vagy kinázok egymással alkotott komplexeinek „befagyasztása” révén.
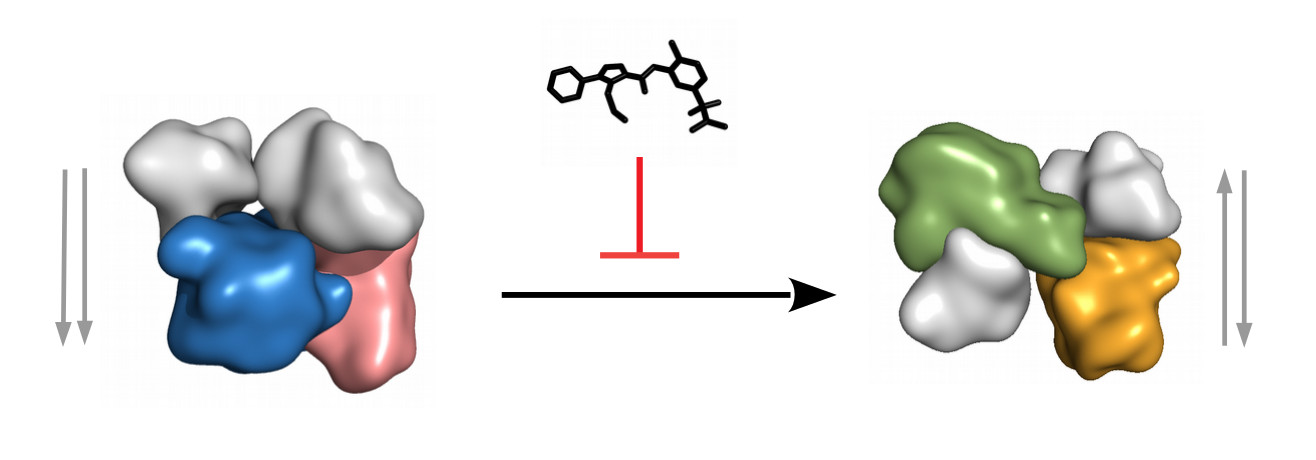
A gyulladási folyamatok egyik központi jelátviteli komplexének szerkezete és gátlása egy komplex-specifikus inhibitorral. A p38-MK2 komplex két eltérő negyedleges szerkezetben létezhet: 1) inaktív (bal oldal), ami a nem-foszforilált p38-at (lazac) tartalmazza és a kináz domének elhelyezkedésének szempontjából paralel konformációban van, 2) anti-paralel aktív (jobb oldal), ami a foszforilált p38-at (narancs) tartalmazza. A kinázdomének N-terminális lebenyét szürke, míg a C-terminális lebenyeket színes felszínek ábrázolják. Egy gyulladáscsökkentő kismolekula a két állapot közötti természetes átmenetet gátolja, mert az inaktív állapotú negyedleges szerkezetet részesíti előnyben. A hatóanyag tehát a p38-MK2 komplexet a p38 aktivációs állapotától függetlenül az inaktív paralel szerkezetben tartja, s így meggátolja a gyulladásfokozó MK2 kináz (kék/zöld) p38 általi foszforilációját/aktivációját.
Publikációk:
Fontosabb publikációk (2012-2022):
Alexa A, Sok P, Gross F, Albert K, Kobori E, Póti ÁL, Gógl G, Bento I, Kuang E, Taylor SS, Zhu F, Ciliberto A, Reményi A.
Nat Commun. 2022 Jan 25;13(1):472. doi: 10.1038/s41467-022-28109-x
Co-regulation of the transcription controlling ATF2 phosphoswitch by JNK and p38.
Kirsch K, Zeke A, Tőke O, Sok P, Sethi A, Sebő A, Kumar GS, Egri P, Póti ÁL, Gooley P, Peti W, Bento I, Alexa A, Reményi A.
Nat Commun. 2020 Nov 13;11(1):5769. doi: 10.1038/s41467-020-19582-3
MAP Kinase-Mediated Activation of RSK1 and MK2 Substrate Kinases.
Sok P, Gógl G, Kumar GS, Alexa A, Singh N, Kirsch K, Sebő A, Drahos L, Gáspári Z, Peti W,Reményi A.
Structure. 2020 Oct 6;28(10):1101-1113.e5. doi: 10.1016/j.str.2020.06.007
Disordered Protein Kinase Regions in Regulation of Kinase Domain Cores.
Gógl G, Kornev AP, Reményi A*, Taylor SS*
Trends Biochem Sci. 2019 Apr;44(4):300-311. doi: 10.1016/j.tibs.2018.12.002.
Dynamic control of RSK complexes by phosphoswitch-based regulation.
Gógl G, Biri-Kovács B, Póti ÁL, Vadászi H, Szeder B, Bodor A, Schlosser G, Ács A, Turiák L, Buday L, Alexa A, Nyitray L, Reményi A.
FEBS J. 2018 Jan;285(1):46-71. doi: 10.1111/febs.14311
Zeke A, Bastys T, Alexa A, Garai Á, Mészáros B, Kirsch K, Dosztányi Z, Kalinina OV, Reményi A.
Mol Syst Biol. 2015 Nov 3;11(11):837. doi: 10.15252/msb.20156269
Gógl G, Schneider KD, Yeh BJ, Alam N, Nguyen Ba AN, Moses AM, Hetényi C, Reményi A*, Weiss EL*
PLoS Biol. 2015 May 12;13(5):e1002146. doi: 10.1371/journal.pbio.1002146
Structural assembly of the signaling competent ERK2-RSK1 heterodimeric protein kinase complex.
Alexa A, Gógl G, Glatz G, Garai Á, Zeke A, Varga J, Dudás E, Jeszenői N, Bodor A, Hetényi C, Reményi A.
Proc Natl Acad Sci U S A. 2015 Mar 3;112(9):2711-6. doi: 10.1073/pnas.1417571112.
Glatz G, Gógl G, Alexa A, Reményi A.
J Biol Chem. 2013 Mar 22;288(12):8596-8609. doi: 10.1074/jbc.M113.452235
Specificity of linear motifs that bind to a common mitogen-activated protein kinase docking groove.
Garai Á, Zeke A, Gógl G, Törő I, Fördős F, Blankenburg H, Bárkai T, Varga J, Alexa A, Emig D, Albrecht M, Reményi A.
Sci Signal. 2012 Oct 9;5(245):ra74. doi: 10.1126/scisignal.2003004
Nemzetközi együttműködések:
Susan S. Taylor – University of California – San Diego, USA
Andrea Ciliberto – IFOM, Milánó, Olaszország
Eric L. Weiss – Northwestern University, USA
Marie Bogoyevitch – University of Melbourne, Ausztrália
Krishna Rajalingam – Johannes Gutenberg-Universität Mainz, Németország
EU-OPENSCREEN: http://www.eu-openscreen.eu/
Vezető
Reményi Attila
Alumni
MSc
Garai Ágnes Szonja (ELTE biológus)
Gógl Gergő (ELTE vegyész)
Fördős Ferenc (ELTE biológus)
Rádli Martina (ELTE biológus)
Glatz Gábor (ELTE biológus)
Zámbó Boglárka (ELTE biológus)
Magyary Sarolt (ELTE vegyész)
Németh Evelin (ELTE vegyész)
Takács Tamás (ELTE biológus)
Ember Orsolya (ELTE vegyész)
Balázs Bettina (SE orvos)
PhD
Glatz Gábor
Garai Ágnes Szonja
Zeke András
Kirsch Klára
Neha Sing
Posztdok
Törő Imre
Bartis Domonkos
Paál Krisztina
Zeke András
Kállainé Szarka Eszter
Egri Péter