- A csoport általános kutatási területe a fehérjék szerkezete, szerkezeti dinamikája, konformációs flexibilitása és működése közötti összefüggések feltárása. Különös figyelmet fordítunk a fehérje-fehérje kölcsönhatások és az allosztérikus jelátvitel szerepére a különböző biológiai folyamatokban. Modell fehérjéink elsősorban olyan komplement proteázok és allosztérikus enzimek, amelyek önszerveződő módon képesek bonyolultabb struktúrákba rendeződni. A csoportban összehangolt módon mind kísérleti, mind pedig számítógépes elméleti munka is folyik.
Főbb kutatási témák
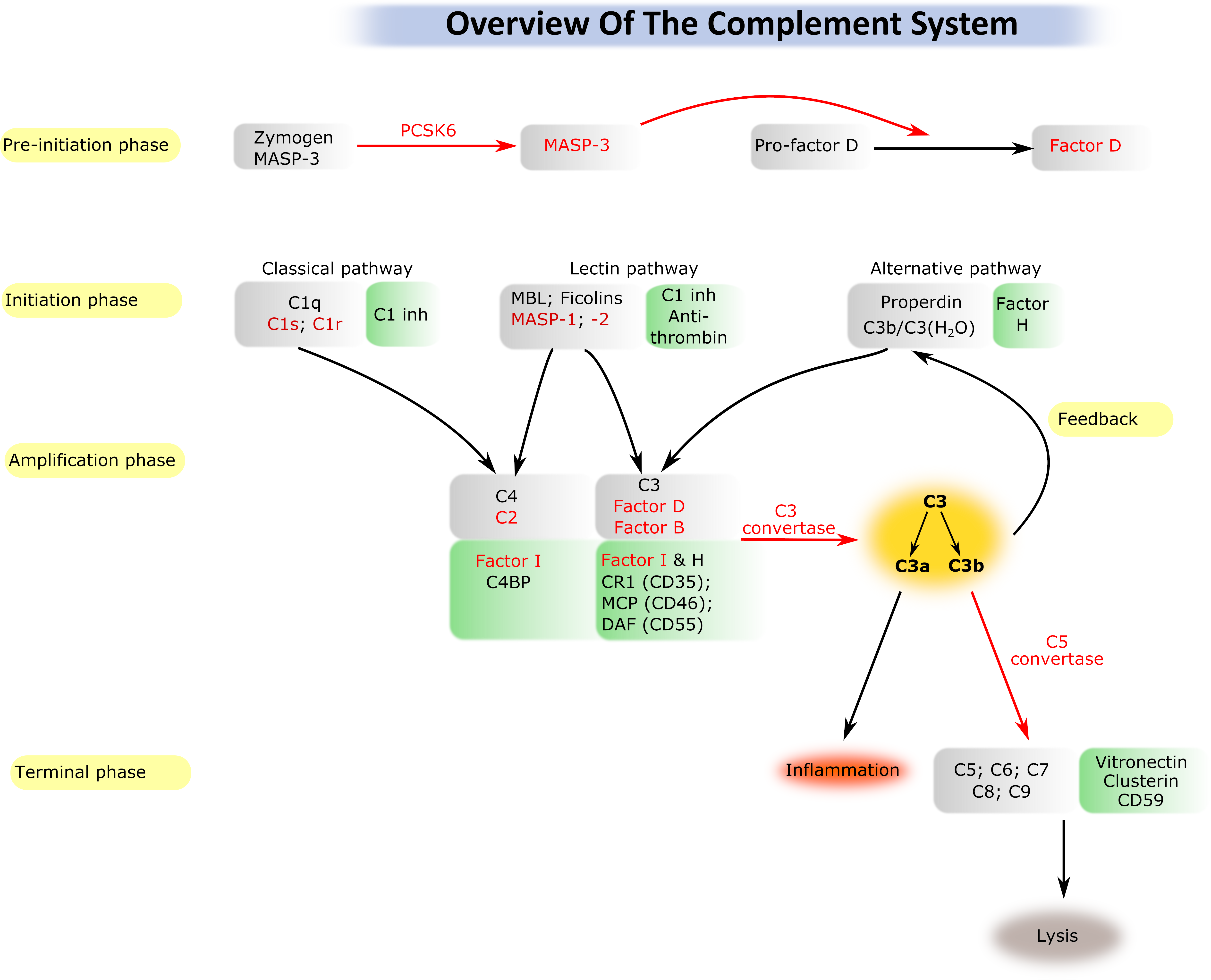
A komplementrendszer aktiválódása és szabályozása
A komplementrendszer a természetes (veleszületett) immunitás egyik ősi ága. A kb. 40 fehérjemolekulából álló rendszer képes a veszélyes struktúrákat (pl. patogén mikroorganizmusok) felismerni, megjelölni és megsemmisíteni. A rendszer gerincét olyan szerin proteáz enzimek alkotják, amelyek egymást kaszkádszerűen aktiválják. A komplementrendszer normális működése szükséges az immunegyensúly fenntartásához; rendellenes, kontroll nélküli aktiválódása azonban a saját szövetek károsodásához vezethet. Manapság egyre több betegségről derül ki, hogy hátterében kisebb vagy nagyobb mértékben a komplementrendszer rendellenes aktiválódása áll. Csoportunkban elsősorban a komplementrendszer beindításában résztvevő szerin proteáz enzimekkel foglalkozunk. Rekombináns formában előállítjuk a különböző proteázokat és szerkezeti biokémiai, biofizikai és enzimológiai módszerekkel jellemezzük tulajdonságaikat. Különös hangsúlyt fektetünk a komplement szerin proteázokat gátló természetes és mesterséges inhibitorok tanulmányozására, fejlesztésére. Kutatócsoportunkban számos, a komplementrendszer aktiválásában szerepet játszó szerin proteáz térszerkezetét határoztuk meg, és jellemeztük enzimatikus tulajdonságaikat. Tisztáztuk az aktiválódás egyik útjának (lektin út) pontos mechanizmusát, ezzel megcáfolva egy korábbi, az irodalomban uralkodó modellt. Nemrégiben alapvető felfedezéseket tettünk a komplementrendszer alternatív útjának aktiválódásával kapcsolatban, és feltártuk a lektin és az alternatív út szoros kapcsolatát.
Az ELTE Biokémia Tanszékével együttműködésben lektin út specifikus inhibitorokat készítettünk. Ezek az inhibitorok rendkívül hasznos alapkutatási eszközöknek bizonyultak és alkalmasak arra is, hogy gyógyszerfejlesztés alapjául szolgáljanak. Alapítottunk egy spin-off vállalkozást (EvolVeritas Kft.), azért, hogy kockázati tőke bevonásával tudjuk végezni a gyógyszerfejlesztést.
A pre-iniciációs fázisban egy proprotein konvertáz aktiválja a MASP-3 enzimet, ami ezután aktiválja a pro-D-faktort. Az aktivációs szakaszban a D-faktor (FD) aktiválja a C3b-hez kötött B-faktort (FB) előállítva ezzel a C3-konvertáz komplexet (C3bBb).
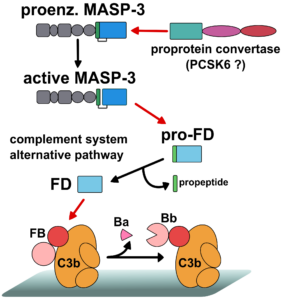
2. ábra
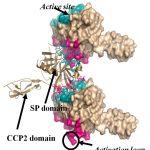
Mutációk és poszttranszlációs módosítások hatása a fehérjék szerkezetére és dinamikájára
A humán genom projektek hatalmas számú ún. nem-szinonim egynukleotidos variációt tártak fel, mely jelzi a létező fehérjemutációk igen nagy számát. Ezek közül a mutációk közül számos betegségekkel függ össze. A jövőben a személyre szabott orvoslás keretében várható, hogy minden beteg teljes genomját megszekvenálják, és ennek elemzése alapján kap ellátást. Ezért szükség van az egyéni variációk értelmezését lehetővé tevő módszerekre. A különféle mutációkat az egyes fehérjék 3D szerkezetére rávetítve fontos ismeretekhez juthatunk a fehérje funkcióját illetően, és megérthetjük, hogyan befolyásolja azt egy-egy mutáció. Hasonló hatása van poszttranszlációs módosításoknak is (pl. a foszforiláció), amelyek kulcsfontosságúak a jelátviteli folyamatokhoz, de sokuk funkciója még ismeretlen. A mutációk és a poszttranszlációs módosítások is többféleképpen befolyásolják a fehérjék funkcióját, többek között a fehérjedinamika modulációja révén is. Ezeket a hatásokat tárjuk fel különféle fehérjéken, pl. enzimeken és szabályozófehérjéken, olyan szimulációk révén, amelyek leírják a fehérjék funkcionális dinamikáját, és képesek leírni a szerkezetváltozásokat és a dinamikai folyamatok megváltozását.
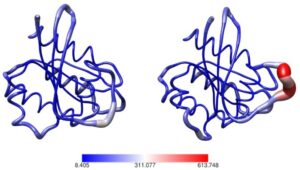
3. ábra
A rákos és gyulladásos folyamatokban szerepet játszó jelátviteli fehérjék kölcsönhatásainak kimutatása és jellemzése
A sejtek alapvető élettani folyamatai lényegében makromolekuláris hálózatok szabályozott működésén nyugszanak. A jelátviteli útvonalak különböző típusú (erős és gyenge, közvetlen és közvetett) fehérje-fehérje kölcsönhatásokból állnak, melyek megfelelően szabályozzák a rendszerint allosztérikus természetű enzimek működését. A fehérjekonformáció flexibilitásán alapuló allosztérikus szabályozás jelentősége az enzimek működésében jól ismert és csoportunk korábbi, egyedi enzimek vizsgálatával elért kísérleti eredményei további betekintést nyújtottak ilyen mechanizmusokba. E tudás birtokában a jelen projekt keretében olyan jelátviteli folyamatokban szerepet játszó enzim-enzim kölcsönhatásokat kívánunk azonosítani és molekuláris szinten jellemezni, amely folyamatok patofiziológiás jelentősége feltételezhető. Pl. a krónikus gyulladásos és rákos folyamatok között sejthető összefüggés vizsgálatainkat olyan fehérje-fehérje kölcsönhatások tanulmányozása felé tereli, melyekben bizonyos kinázok (Aurora, Rock1, Rock2 ill. foszfoglicerát kináz) és foszfodiészterázok (PDE4, PDE5) szerepe vár tisztázásra. A kölcsönhatások feltérképezését és jellemzését egyrészt in vivo emlős sejteken végzett, másrészt in vitro enzimológiai és fehérjekémiai vizsgálatokkal végezzük.
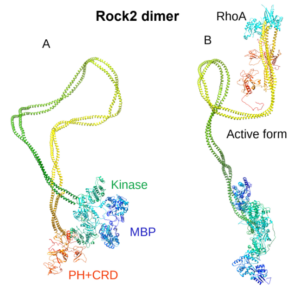
4. ábra
Munkatársak
- Baksa Attila, tudományos segédmunkatárs
- Balczer Júlia, technikus
- Dobó József, PhD, tudományos főmunkatárs
- Farkas Bence, PhD hallgató
- Gál Péter, PhD, DSc, csoportvezető, tudományos tanácsadó
- Hajdú István, PhD, tudományos munkatárs
- Martinusz Róbert, hallgató
- Nagy Olivér, hallgató
- Pataki Judit, technikus
- Párisné Kocsis Andrea, PhD, tudományos munkatárs
- Végh Barbara, PhD, tudományos munkatárs
- Závodszky Péter, akadémikus, professzor emeritus
Végzett PhD hallgatók
- Beinrohr László (2010)
- Gyimesi Gergely (2011)
- Major Balázs (2012)
- Párisné Kocsis Andrea (2012)
- Megyeri Márton (2012)
- Paréj Katalin (2015)
- Györffy Dániel (2015)
- Sajó Ráchel (2016)
- Oroszlán Gábor (2018)
- Dani Ráhel (2022)
Válogatott közlemények
- Németh Z, Debreczeni ML, Kajdácsi E, Dobó J, Gál P, Cervenak L. (2023) Cooperation of Complement MASP-1 with Other Proinflammatory Factors to Enhance the Activation of Endothelial Cells. Int J Mol Sci. 24(11):9181.
- Dani R, Oroszlán G, Martinusz R, Farkas B, Dobos B, Vadas E, Závodszky P, Gál P, Dobó J. (2023) Quantification of the zymogenicity and the substrate-induced activity enhancement of complement factor D. Front Immunol. 14:1197023.
- Golomingi M, Kohler J, Jenny L, Hardy ET, Dobó J, Gál P, Pál G, Kiss B, Lam WA, Schroeder V. (2022) Complement lectin pathway components MBL and MASP-1 promote haemostasis upon vessel injury in a microvascular bleeding model. Front Immunol. 13:948190.
- Nagy ZA, Héja D, Bencze D, Kiss B, Boros E, Szakács D, Fodor K, Wilmanns M, Kocsis A, Dobó J, Gál P, Harmat V, Pál G. (2022) Synergy of protease binding sites within the ecotin homodimer is crucial for inhibition of MASP enzymes and for blocking lectin pathway activation. J Biol Chem. 25:101985.
- Oroszlán G, Dani R, Végh BM, Varga D, Ács AV, Pál G, Závodszky P, Farkas H, Gál P, Dobó J. (2021) Proprotein Convertase Is the Highest-Level Activator of the Alternative Complement Pathway in the Blood. J Immunol. 206, 2198-2205.
- Hajdú I, Szilágyi A, Végh BM, Wacha A, Györffy D, Gráczer É, Somogyi M, Gál P, Závodszky P. (2020) Ligand-induced conformational rearrangements regulate the switch between membrane-proximal and distal functions of Rho kinase 2. Commun Biol. 3(1):721.
- Nagy ZA, Szakács D, Boros E, Héja D, Vígh E, Sándor N, Józsi M, Oroszlán G, Dobó J, Gál P, Pál G. (2019) Ecotin, a microbial inhibitor of serine proteases, blocks multiple complement dependent and independent microbicidal activities of human serum. PLoS Pathog. 15:e1008232.
- Szakács D, Kocsis A, Szász R, Gál P, Pál G. (2019) Novel MASP-2 inhibitors developed via directed evolution of human TFPI1 are potent lectin pathway inhibitors. J Biol Chem. 294, 8227-8237.
- Paréj K, Kocsis A, Enyingi C, Dani R, Oroszlán G, Beinrohr L, Dobó J, Závodszky P, Pál G, Gál P. (2018) Cutting Edge: A New Player in the Alternative Complement Pathway, MASP-1 Is Essential for LPS-Induced, but Not for Zymosan-Induced, Alternative Pathway Activation. J Immunol. 200, 2247-2252.
- Dobó J, Szakács D, Oroszlán G, Kortvely E, Kiss B, Boros E, Szász R, Závodszky P, Gál P, Pál G. (2016) MASP-3 is the exclusive pro-factor D activator in resting blood: the lectin and the alternative complement pathways are fundamentally linked. Sci Rep. 6:31877.
- Kidmose, R.T., Laursen, N.S., Dobó, J., Kjaer, T.R., Sirotkina, S., Yatime, L., Sottrup-Jensen, L., Thiel, S., Gál, P. and Andersen, G.R. (2012) ¬Structural basis for activation of the complement system by C4 cleavage. Proc. Natl. Acad. Sci. USA, 109, 15425-15430
- Héja, D., Kocsis, A., Dobó, J., Szilágyi, K., Szász, R., Závodszky, P., Pál, G. and Gál, P. (2012) Revised mechanism of complement lectin-pathway activation revealing the role of serine protease MASP-1 as the exclusive activator of MASP-2. Proc. Natl. Acad. Sci. USA, 109, 10498-10503
Aktuális együttműködések
Komplement kutatás
ELTE Biokémiai Tanszék, Biológiai Intézet
SOTE III. sz. Belgyógyászati Klinika, Kutatólaboratórium
University of Aarhus, Dánia
University Hospital, Bern, Svájc
University of British Columbia, Vancouver, Kanada
Bioinformatika
SOTE Orvosi Vegytani, Molekuláris Biológiai és Patobiokémiai Intézet
University of Michigan, USA
Főbb műszerek, berendezések
FPLC berendezés fehérjetisztításhoz
QCM, DSC, FT IR
Oktatási tevékenység
Alapképzés: Pázmány Péter Katolikus Egyetem, Műszaki Informatikai Kar: biokémia, biofizika, molekuláris biológia oktatása; ELTE TTK: biofizika, fizikai-biokémia kurzusok
B.Sc. és M.Sc. szakdolgozók témavezetése: ELTE (biológus, vegyész), BME (biomérnök)
Ph.D. hallgatók témavezetése: ELTE Biológiai Doktori Iskola, BME Oláh György Doktori Iskola
Vezető
Gál Péter