Kutatási terület
A Sejtélettani Kutatócsoport fő kutatási területe a G-fehérje kapcsolt receptorok. Fő hangsúly a receptorok jelátviteli útjainak feltárásán van, különös tekintettel a β-arresztinek szerepére. Elkötelezettek vagyunk a sejtszintű jelátvitel megértésének előmozdításában, és kutatjuk a β-arresztinek funkcióit mind a GPCR jelátvitelben, mind a GPCR-ektől független folyamatokban. Kutatjuk továbbá ezen fehérjék kölcsönhatását a citoszkeletális rendszerrel.
A sejtszignalizáció vizsgálata: G-fehérje kapcsolt receptorok, Arresztinek, Ligand-Receptor Interakció és egyéb aspektusok
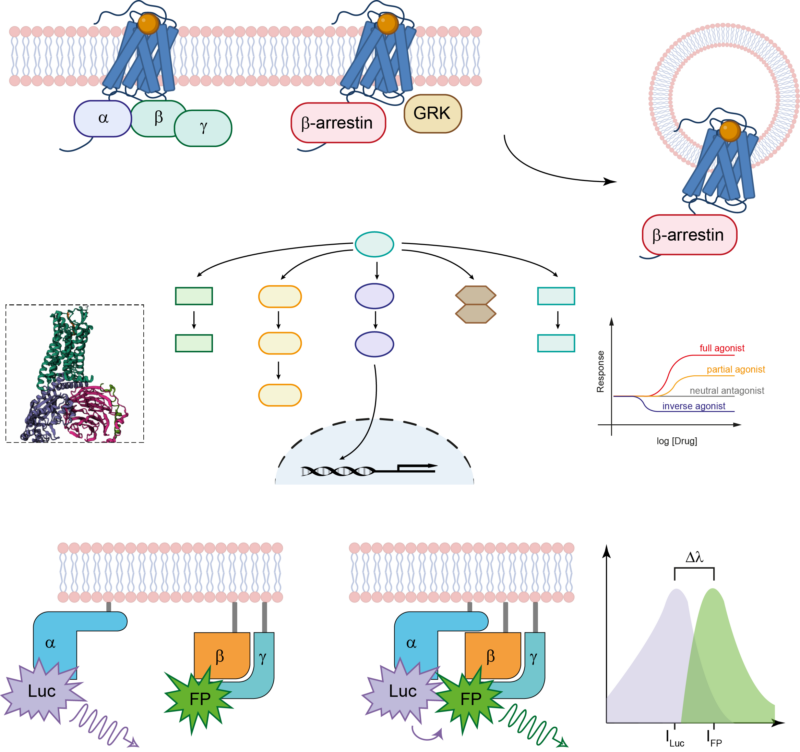
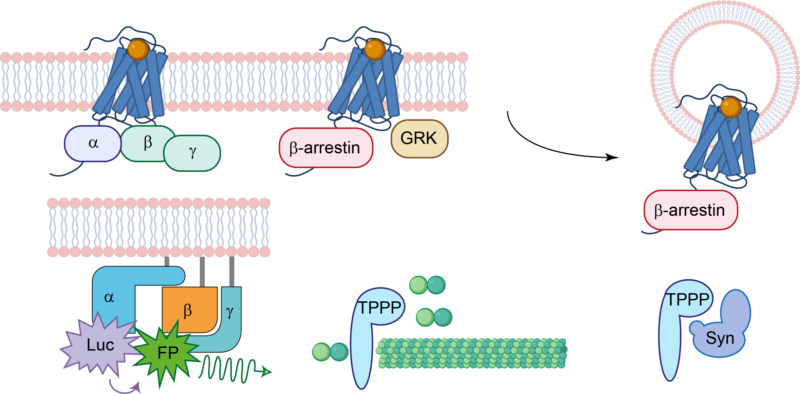
A fő kutatási területünk a G-fehérje kapcsolt receptorok világa, ahol a ligand-receptor kölcsönhatások, a β-arrestin funkciók és az intracelluláris jelátvitel alapvető vonatkozásait vizsgáljuk. A G-fehérje kapcsolt receptorok kutatása során az AT1 angiotenzin receptor (AT1R) áll a középpontban, mint a G-fehérje kapcsolt receptorok prototípusa, amely szerepet játszik különböző fiziológiai és patológiás állapotokban. A G-fehérje kapcsolt receptorok túlmutatóan kutatásaink az egyik legismertebb receptorpartner fehérjék, az ún. β-arresztinek jelátviteli hálózatára irányulnak. A β-arresztinek nemcsak a G-fehérje kapcsolt receptorokkal, hanem egy sor nem receptorfehérjével is kölcsönhatásba lépnek. Ez a kutatás a β-arresztinek szabályozó szerepének feltérképezését célozza különböző intracelluláris jelátviteli utakon. Molekuláris biológiai, biofizikai és biokémiai módszerek alkalmazunk, kiegészítve a legmodernebb bioinformatikai megközelítésekkel. Munkánk nemcsak hozzájárul a receptorszignalizációs folyamatok jobb megértéséhez, hanem új lehetőségeket vet fel az innovatív gyógyszerfejlesztés és terápiás beavatkozások terén.
A TPPP a mikrotubuláris hálózat dinamikáját szabályozza és indukálja a Parkinson-kórt fémjelző alfa-szinuklein patológiás aggregációját
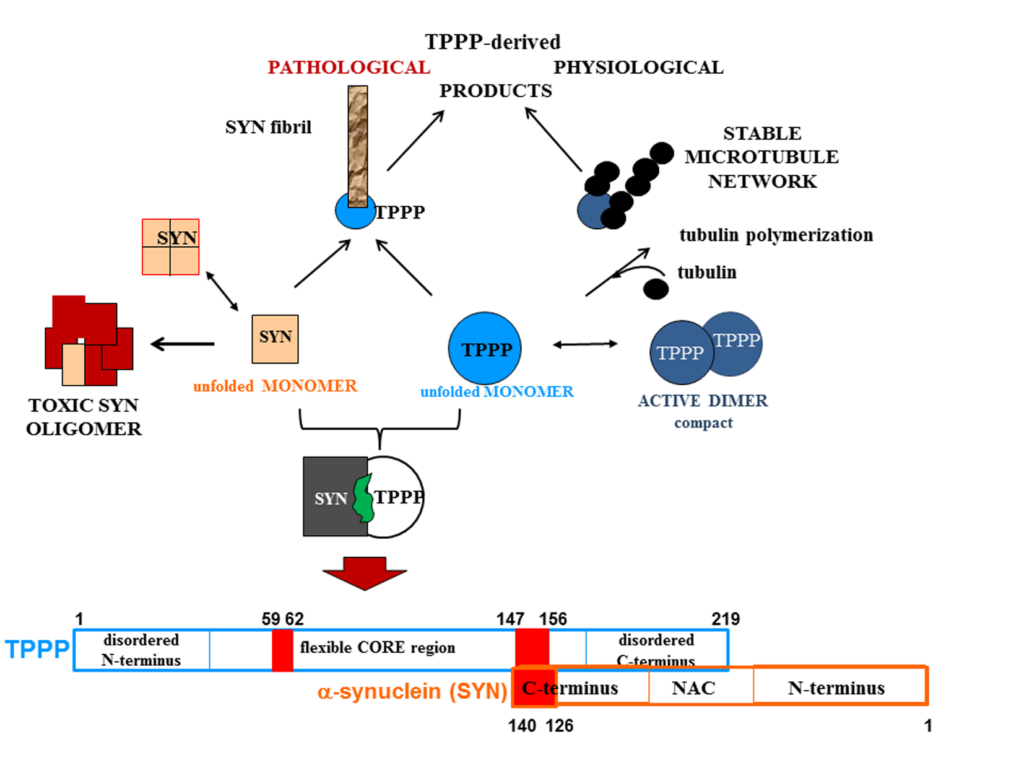
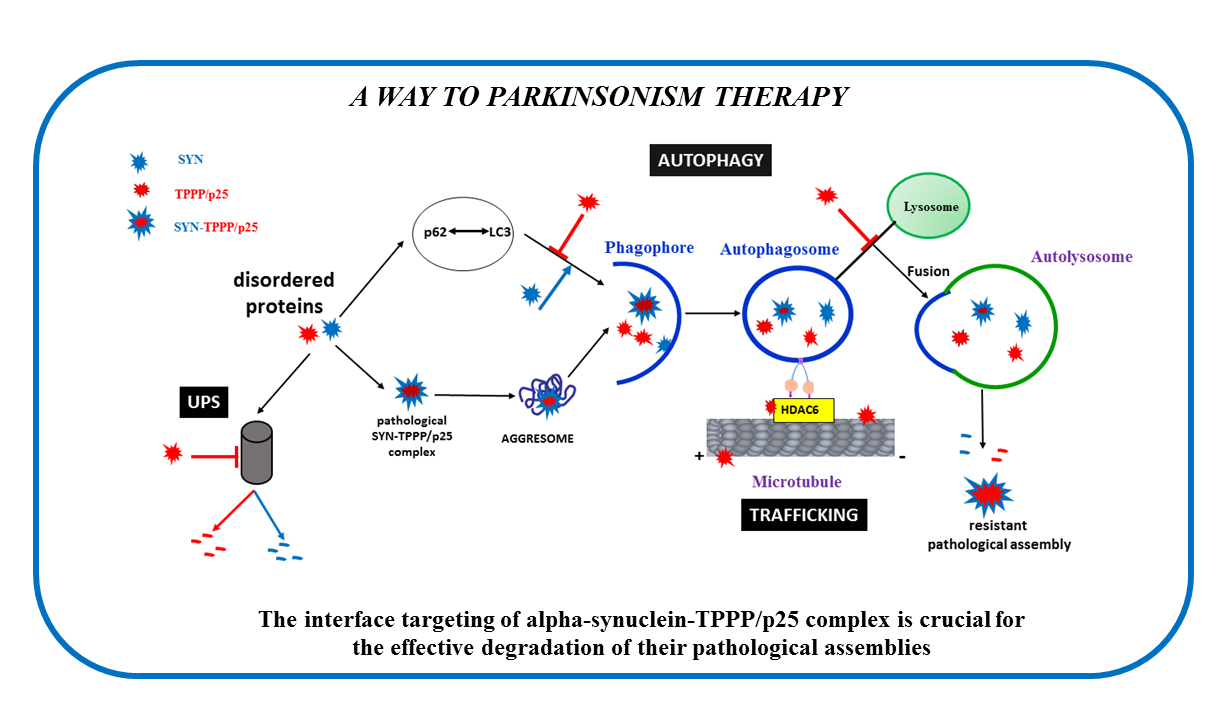
A fiziológiás és patológiás folyamatok szempontjából kulcsfontosságú dinamikus mikrotubuláris hálózat egyik partnere a Tubulin Polymerization Promoting Protein (TPPP), amely az agy fejlődése során oligodendrocitákban fejeződik ki. A multifunkcionális TPPP a mikrotubulusok dinamikáját és stabilitását szabályozza, gátolja a sejtproliferációt, és szerepet játszik a Parkinson-kórban. A Parkinson-kórban a TPPP és az alfa-szinuklein (SYN) együtt lokalizálódnak, ami gátolja a sejtes mechanizmusokon keresztüli eliminációjukat. A két fehérje különböző sejttípusokban fejeződik ki a normál agyban; oldható homo- és hetero-oligomerjeik a Parkinson-kór végzetes specieszei. Kutatásunk hangsúlyozza a TPPP kulcsszerepét, és egy ” interface-targeting stratégiát” javasol a SYN-TPPP aggregációjának megakadályozására, új megközelítést kínálva a toxikus fehérje-aggregátumok eltávolítására. Ennek a felfedezésnek jelentős hatása lehet a klinikai kutatásban és a SYN-TPPP kötőfelszínt megcélzó gyógyszerfejlesztésben.
Együttműködések
Nemzetközi együttműködés
- Albert-Ludwigs-Universität Freiburg, Germany
- Faculty of Science, University of Rouen, France
- National Institutes of Health, Bethesda, MD, USA
- Perelman School of Medicine, University of Pennsylvania, Philadelphia, PA, USA
Hazai együttműködés
- HUN-REN Szerves Kémiai Intézet
- Semmelweis Egyetem, Élettani Intézet
- Semmelweis Egyetem, Reumatológiai és Klinikai Immunológiai Tanszék
- Immunológiai Intézet, Pécsi Tudományegyetem, Pécs
- Immunológiai Tanszék, ELTE, Budapest
- Szerves Kémiai Tanszék, Kémiai Intézet, ELTE, Budapest
- Immunogenes Kft., Budapest Hungary
TTK-n belüli együttműködés
- Onkológiai Biomarker Kutatócsoport, Enzimológiai Intézet
- Molekuláris Sejtbiológiai Kutatócsoport, Enzimológiai Intézet
- NMR Kutató Laboratórium Műszercentrum
- Szerves Kémiai Intézet
A kutatócsoport tagjai:
- Hunyady László : Cikkek
- Ovádi Judit : Cikkek
- Orosz Ferenc: Cikkek
- Lehotzky Attila : Cikkek
- Szénási Tibor : Cikkek
- Oláh Judit : Cikkek
- Turu Gábor : Cikkek
- Soltész-Katona Eszter : Cikkek
- Tóth András : Cikkek
- Szalai Bence : Cikkek
Legutóbbi publikációk:
- Tóth AD, Soltész-Katona E, Kis K, Guti V, Gilzer S, Prokop S, Boros R, Misák Á, Balla A, Várnai P, Turiák L, Ács A, Drahos L, Inoue A, Hunyady L, Turu G. ArreSTick Motif is Responsible for GPCR-β-Arrestin Binding Stability and Extends Phosphorylation-Dependent β-arrestin Interactions to Non-Receptor Proteins. bioRxiv 2023.08.04.551955
- Tóth AD, Szalai B, Kovács OT, Garger D, Prokop S, Balla A, Inoue A, Várnai P, Turu G, Hunyady L. Receptor endocytosis orchestrates the spatiotemporal bias of β-arrestin signaling. bioRxiv 2023.04.27.538587
- Mathur L, Szalai B, Du NH, Utharala R, Ballinger M, Landry JJM, Ryckelynck M, Benes V, Saez-Rodriguez J, Merten CA. Combi-seq for multiplexed transcriptome-based profiling of drug combinations using deterministic barcoding in single-cell droplets. Nat Commun. 2022 Aug 1;13(1):4450. doi: 10.1038/s41467-022-32197-0. PMID: 35915108
- Lehotzky A, Oláh J, Fekete JT, Szénási T, Szabó E, Győrffy B, Várady G, Ovádi J. Co-Transmission of Alpha-Synuclein and TPPP/p25 Inhibits Their Proteolytic Degradation in Human Cell Models. Front Mol Biosci. 2021 May 18;8:666026. doi: 10.3389/fmolb.2021.666026. eCollection 2021. PMID: 34084775
- Barsi S, Papp H, Valdeolivas A, Tóth DJ, Kuczmog A, Madai M, Hunyady L, Várnai P, Saez-Rodriguez J, Jakab F, Szalai B. Computational drug repurposing against SARS-CoV-2 reveals plasma membrane cholesterol depletion as key factor of antiviral drug activity. PLoS Comput Biol. 2022 Apr 11;18(4):e1010021.
- Tóth AD, Garger D, Prokop S, Soltész-Katona E, Várnai P, Balla A, Turu G, Hunyady L. A general method for quantifying ligand binding to unmodified receptors using Gaussia luciferase. J Biol Chem. 2021 Jan-Jun;296:100366.
- Oláh J, Lehotzky A, Szunyogh S, Szénási T, Orosz F, Ovádi J. Microtubule-Associated Proteins with Regulatory Functions by Day and Pathological Potency at Night. Cells. 2020 Feb 4;9(2):357. doi: 10.3390/cells9020357. PMID: 32033023
- Orosz F. Apicortin, a Constituent of Apicomplexan Conoid/Apical Complex and Its Tentative Role in Pathogen-Host Interaction. Trop Med Infect Dis. 2021 Jun 30;6(3):118. doi: 10.3390/tropicalmed6030118. PMID: 34209186
- Tóth AD, Turu G, Hunyady L, Balla A. Novel mechanisms of G-protein-coupled receptors functions: AT1 angiotensin receptor acts as a signaling hub and focal point of receptor cross-talk. Best Pract Res Clin Endocrinol Metab. 2018 Apr;32(2):69-82.
- Tóth AD, Prokop S, Gyombolai P, Várnai P, Balla A, Gurevich VV, Hunyady L, Turu G. Heterologous phosphorylation-induced formation of a stability lock permits regulation of inactive receptors by β-arrestins. J Biol Chem. 2018 Jan 19;293(3):876-892.
Végzett PhD hallgatók:
- ZotterÁgnes PhD 2013 (témavezető Prof. Ovádi Judit)
- Szunyogh Sándor PhD 2017 (témavezető Prof. Ovádi Judit )
- Szabó Adél PhD 2019 (témavezető Dr. Oláh Judit)
- Soltész-Katona Eszter PhD 2022 (témavezető Prof. Hunyady László 50%, Dr. Turu Gábor 50%)
Vezető
Hunyady László