Általános kutatási terület
Kettős szerepben: A DNS “hibák” jelentősége a DNS-javításban és a jelátvitelben
Sejtjeinkben a DNS-alapú genetikai információ állandóan ki van téve olyan környezeti tényezőknek, melyek számos kémiai átalakulást okoznak és az így módosult DNS információtartalma megváltozik. Fontos tudni, hogy ún. normál, élettani körülmények között is naponta több száz mutagén módosulás következik be a humán genomnak megfelelő méretű DNS-en, így ezek állandó vizsgálata és javítása elsőrendű fontossággal bír. Számos DNS hibafelismerő és javító mechanizmus létezik, és napjainkra azt is felismerték, hogy a DNS módosulások felismerése és processzálása a DNS-javításon túlmenően génkifejeződési, epigenetikai és fejlődési,folyamatokat vezérel. A fenti nagy területen belül csoportunk a bázishibák/bázismódosulások létrejöttére és javítására fókuszál. A Genom Metabolizmus Kutatócsoport célja a genomi integritás fenntartásáért felelős mechanizmusok kutatása, ezen belül lényegileg új, átütő eredmények elérése. Megközelítési módszerünk a hipotézis-alapú kutatás ezen az adott biológiai problémán, amivel az organizmusok (Drosophila, Mycobacterium, Staphylococcus) és sejtvonalak szintjén felmerült kérdést a fehérjék molekuláris szintjéig lebontva és onnan felépítve tanulmányozzuk.
Főbb kutatási témák
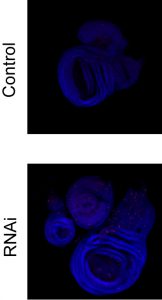
A DNS-beli uracil élettani szerepének vizsgálata genomszintű térképezéssel humán sejtvonalakon és teljes átalakulással fejlődő rovarokban (Drosophila melanogaster törzsekben való részletes fejlődésbiológiai, genetikai és sejtbiológiai vizsgálatokkal)
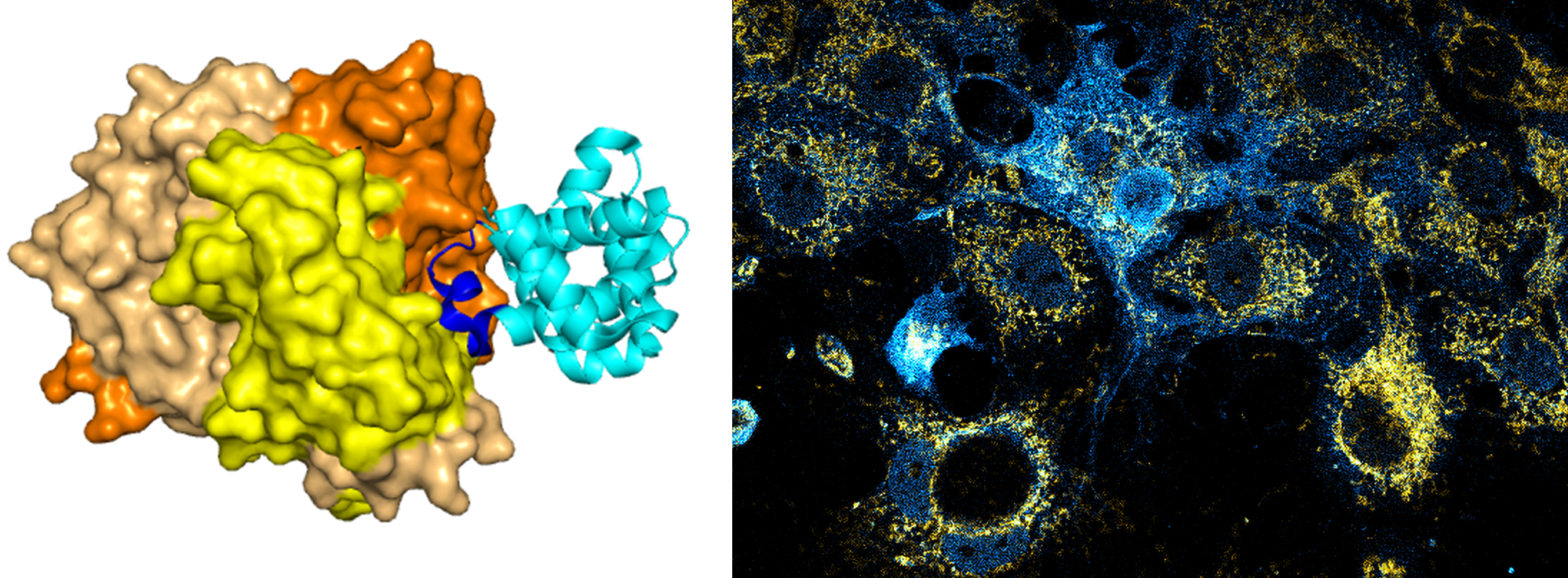
Kutatócsoportom fókuszában egy paradigma váltás áll, ami az uracil DNS-ben való szerepére vonatkozik. A DNS-beli uracil bázist sokáig csupán hibaként kezelték. Az uracil elkerülésében a nukleotid építőkövek egyensúlyáért felelős bioszintézis útvonalak között a dUTPáz enzimnek van kiemelkedő jelentősége, míg a DNS-ből való uracil eltávolításért a báziskivágási javító útvonal felel. Ezzel a tradicionális hiba-szereppel szemben az elmúlt években több kutatócsoport, köztük a miénk is, igazolta a DNS-beli uracil újféle szerepeit az alábbi folyamatokban:
- immunoglobulin gén diverzifikáció,
- transzkripciós szabályozás,
- HIV életciklus segítése, és
- fejlődésbiológia.
Ezeket a problémákat a fenti modellszervezetekben vizsgáljuk.
Timinmentes sejthalál útvonal vizsgálata
Egy másik alapkutatási célunk a dUTPáz hiányában fellépő ún. timinmentes sejthalál jelátviteli útvonalának tisztázása. Ezen sejthalál útvonal orvosbiológiai jelentőségét az adja, hogy a klinikumban napjainkban használatos tumorellenes kemoterápiák hozzávetőlegesen egyharmadában a timidilát bioszintézist perturbáló gyógyszereket alkalmaznak (fluoro-nukleozidok, methotrexát és analógjai). A mellékhatások egy része a terápia személyre szabásával csökkenthető lenne – ehhez szeretnénk kutatásainkkal hozzájárulni az adott útvonalak jellemzésével és aztán erre alapozva személyre szabott diagnosztikával.
Egy molekuláris kapcsoló kutatása: A Staphylococcus aureus patogenitás szigeteinek szabályozásában szerepet játszó fehérjék vizsgálata
A bakteriális genom gyakran tartalmaz olyan mobilis genetikai elemeket, melyek a bakteriális kromoszómához képest többé-kevésbé független módon képesek replikálódni. Ezek némelyike fág-eredetű és köztük kiemelt jelentőségük van az ún. patogenicitási szigeteknek (PI). A patogenicitási szigetek orvosbiológiai szempontból való kiemelt jelentősége abban rejlik, hogy felelősek számos virulencia faktor és toxin (pl. a toxikus sokk szindróma toxinja) különböző törzsek közötti elterjesztéséért. A jelen projektben több különböző nézőpontból kívánunk górcső alá venni egy olyan génkifejeződési szabályozó mechanizmust, melyen belül a represszió és a derepresszió egy a Staphylococcus auerus-ra jellemző patogenicitási szigethez kapcsolt.
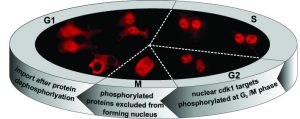
A sejtmag és a citoplazma közötti makromolekuláris transzport szabályozásának vizsgálata térben és időben
Az ún. megelőző DNS-javításban fontos nukleotid metabolizmus útvonalak, ezek között a dUTPáz enzim sejtmagi és mitokondriális lokalizációja eukariótákban szinte mindenhol megfigyelhető. Kérdéses viszont ennek a lokalizációnak és szabályozásának mechanizmusa, amire igyekszünk fényt deríteni. Ennek kapcsán a sejtciklushoz kötött (cdk1 kináz általi) foszforiláció érdekes dinamikus szabályozó szerepére bukkantunk, ami a humán proteóm számos fehérjéjére is érvényes lehet. A foszforiláció lehetőségének megszüntetése, illetve a foszforilációs konstitutív mimikálása a szerin pozíció glutamin ill. glutaminsav mutációjával döntően befolyásolja a leánysejtek magi proteómjának dUTPáz készletét. Ezen megfigyelésünk valószínűleg általános érvényű szabályozó mechanizmusra világít rá. Munkahipotézisünk szerint az NLS környéki pozíciók cdk1 kináz általi foszforilációja lényegi módon befolyásolhatja számos humán fehérje dinamikus sejtmagi transzportját.
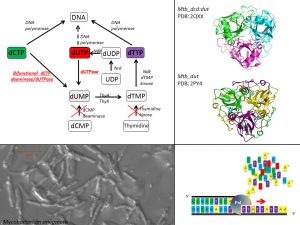
Fehérjétől a sejtig: mutáns dUTPázok élettani hatásainak in vivo vizsgálata Mycobacterium smegmatisban
A mikobakteriális timidilát szintézis, mint anti-tuberkulózis gyógyszer célpont. A timidilát bioszintézis minden sejtben létfontosságú, mivel a belőle keletkező dTTP a DNS szintézis egyik építőköve. Három útvonal is létezik a timidilát bioszintézisére, de az epidemiológiailag jelentős kórokozókat (Mycobacterium tuberculosis és a Mycobacterium leprae, a tuberkulózis és a lepra kórokozói) is felvonultató mikobaktériumokban ezekből csak egy útvonal enzimei találhatók meg. Ebben az útvonalban a dUTPáz reakció központi szerepet játszik, ezért a mikobaktériumok ideális modellszervezetként szolgálnak a dUTPáz enzim élő sejtben történő vizsgálatához. A kiegyensúlyozott dNTP készlet fenntartása mellett a dUTP elbontása megakadályozza az uracil hibás beépülését a genomba, ezáltal fontos mikobakteriális gyógyszer célpontként szolgál.
A mikobakteriális timidilát szintézis útvonalba tartozó enzimek mechanizmusát és speciális mutánsait vizsgáljuk biokémiai módszerekkel. Ezt továbbá kombináljuk in vivo tesztekkel is, amelyekben a mikobakterium genetikai módosításával mutáns enzimeket viszünk be a genomban található enzimkópia helyére, és így az előzőleg biokémiailag karakterizált mutáció hatását tudjuk vizsgálni az élőlény növekedésére.
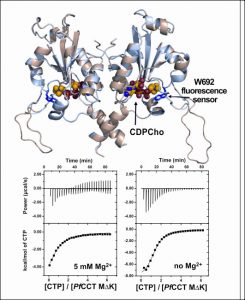
Plasmodium falciparum elleni hatóanyagok kifejlesztését távlatilag célzó kutatások a lipid-bioszintézisben kulcsszerepet játszó CCT enzim (CTP:citidilil-transzferáz) vizsgálatával
A kiterjedt és aktív kutatások ellenére, a malária továbbra is korunk egyik legfenyegetőbb fertőző betegsége. A kór okozói Plasmodium fajok, közülük a Plasmodium falciparum a legveszélyesebb. A multirezisztens törzsek terjedése egyre inkább sürgeti új fehérje célpontok azonosítását és ezek ellen újszerű hatóanyagok fejlesztését. A jelen kutatási téma a Plasmodium foszfolipid bioszintézisében részt vevő, kiemelt jelentőségű enzim, a CTP:foszfokolin citidililtranszferáz karakterizálását célozza, amely egy újonnan kifejlesztett, már klinikai 2-es fázisban lévő gyógyszerjelölt támadáspontja.
Enzim mechanisztikai kutatások a nukleozid-trifoszfátok hidrolízisét az alfa-foszfátcsoporton történő nukleofil támadással katalizáló enzimcsaládokon
dUTPázok, citidilil-transzferázok, DNS polimerázok, ligázok és Nudix hidrolázok összehasonlító vizsgálatai
Aktuális együttműködések
Buday László, MTA TTK
Liliom Károly, MTA TTK
Szűts Dávid, MTA TTK
Vékey Károly, MTA TTK
Perczel András, ELTE
Harmat Veronika, ELTE
Náray-Szabó Gábor, ELTE
Nyitray László, ELTE
Kovács Mihály, ELTE
Málnási-Csizmadia András, ELTE
Vellai Tibor, ELTE
Nyulászi László, BME
Poppe László, BME
Oláh Julianna, BME
Fésüs László, DE
Matthias Wilmanns, EMBL Hamburg
Barabás Orsolya, EMBL Heidelberg
Dolores Gonzalez-Pacanowska, Granada
Keith Wilson, Univ York
Iva Pichova, Czech Academy of Science, Prága
Henri Vial Univ Montpellier
Rachel Cerdan Univ Montpellier
Bostjan Kobe Univ Queensland
Főbb műszerek, berendezések
Nanodrop spektrofotométer
RT Q-PCR
Transient kinetics “stopped-flow” Applied Biophysics
Leica epifluoreszcens mikroszkóp
Rock Imager: automata kristály-analizátor
Mosquito: kristályosító robot
(v.ö továbbá: www.biostruct.org)
Oktatási tevékenység
MSc és PhD kurzusok (Bioreguláció, DNS hibajavítás, Szerkezeti és molekuláris biológia, Kémiai Biológia)
TDK, BSc és MSc témák témavezetése (TDK eredmények 1-3 helyzések, OTDK: 1-3 helezések, Pro Scientia elismerések)
PhD témavezetés (v.ö. www.doktori.hu, Vértessy G. Beáta és Tóth Judit)
Vezető
Vértessy G. Beáta