Két amerikai tudós, a 69 éves Robert J. Lefkowitz és az 57 esztendős Brian K. Kobilka kapta az idei kémiai Nobel-díjat. A Svéd Királyi Tudományos Akadémián bejelentett döntést meghozó bizottság szerint a két kutató a sejtműködés szabályozásában fontos szerepet játszó G-fehérje-kapcsolt receptorok vizsgálata terén elért eredményeivel érdemelte ki a díjat.
A teljes cikk itt olvasható: mta.hu
Kémiai Nobel díj-2012: receptorszerkezetért először
A kémia hatáskeresztmetszete örvendetesen nő! Nemcsak biokémiai, hanem már összetett élettani folyamatok is kémiai részleteikben válnak ismertté: számtalan biokatalizátor fehérje után sejtmembránba ágyazott jelfogó receptorfehérjék térszerkezete is kibontakozik. Ez lehetővé teszi fontos élettani folyamatok molekuláris farmakológiai szabályozását.
2003-ban még a receptorokkal rokonszenvező kémikusokat is meglephette, hogy Roderick MacKinnon nem orvosi-élettani, hanem kémiai Nobel díjat kapott kálium-szelektív ioncsatornák szerkezeti és mechanizmusvizsgálataiért. Az ilyen ioncsatornákat a sejtmembrán feszültségváltozása nyitja-csukja. A receptorokat viszont ligandumok aktiválják. Receptorszerkezetek feltárásáért most adtak először Nobel díjat, mégpedig kémiait.
A két díjazott amerikai biokémikus, Robert Lefkowitz és Brian Kobilka, valóban úttörő és kiemelkedő szerepet játszott a hét transzmembrán hélix szerkezetű, G-proteinekhez csatolt receptorok, a legnagyobb receptor-család megismerésében. A mintegy 800 receptorszerkezet – számos neurotranszmitter (adrenalin, dopamin, hisztamin) és hormon (melatonin, neurokinin), a fájdalom (ópiát), fény (rodopszin), szagok és ízek jelfogói – igen sokféle és fontos élettani folyamat kulcsszereplői.
Lefkowitz az 1960-as évek végén, amikor a receptor még csak farmakológiai fogalom volt, radioaktív jódizotóppal jelzett adrenalin származékokkal kezdte vizsgálatait. Kimutatta az adrenerg receptorok telíthető ligandumkötő-helyeit, majd szöveti homogenizátumokból kivonta a receptorfehérjéket. Közben kiderült, hogy a jeladó sejt által kibocsátott agonista ligandum, a célsejt membrán-receptoraihoz kötődve, aktiválja azok G fehérjéit, amelyek a célsejtben metabolikus folyamatokat indukálnak (a receptorcsaládot metabotrópnak is nevezik). A 80-as években Kobilka is csatlakozott Lefkowitz csapatához és izolálták az adrenerg receptorokat kódoló géneket. A génszerkezet alapján meghatározták a protein szekvenciáját, majd a sejtmembránt átszelő, hét hélixes szerkezetét. Felismerték szerkezeti hasonlóságát a rodopszinnal, ami a retina fényreceptora. Aztán Kobilkának, már önálló csapatával, két évtizedes szívós munkával, sikerült a legnehezebb: membránreceptorból kristályosítható változatot előállítani. Fel is tárták röntgenkrisztallográfiás szerkezetét. Agonista vagy antagonista ligandumokat kötött szerkezetük különbsége pedig az utóbbi években kezdi megvilágítani az aktivációt eredményező konformációs átalakulásokat. Sorra ismerjük meg a receptorcsalád tagjainak szerkezetét, kötőüregük szelektivitását ligandumaikra és aktivációs mechanizmusuk eltéréseit. Ezzel valóban megnyílik az út a ligandumok tervezése, számos élettani folyamat molekuláris farmakológiai finomhangolása és gyógyszeres terápiája előtt.
Maksay Gábor
az MTA doktora
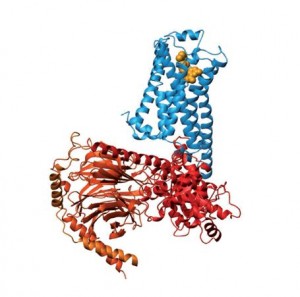
Az aktivált ß-adrenerg receptor-komplex kristályszerkezete (kék). Felszíni kötőüregében agonista (narancsszínű), a membrán belső oldalán G protein (piros). Kobilkáék Nature-cikke (2011) alapján.